
题目列表(包括答案和解析)
11.pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,混合液的pH A.为7.2 B.为8 C.为6 D.无法计算
10.一恒温容器用固定隔板隔成甲、乙两容器如图所示,在甲、乙两容器中分别充入3molA和4molB,反应2A(g)+B(g) 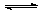 xC(g)达到平衡后,甲容器中A的浓度与乙容器中A的浓度之比为5:3,则达到平衡时甲与乙中C的体积分数为
xC(g)达到平衡后,甲容器中A的浓度与乙容器中A的浓度之比为5:3,则达到平衡时甲与乙中C的体积分数为
A.甲<乙 B.甲>乙 C.甲<乙 D.无法确定
9.某温度下,在一容积不变的密闭容器中,A(g)+2B(g)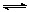 3C(g)达到平衡时,A、B、C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向为
3C(g)达到平衡时,A、B、C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向为
A.向左移动 B.向右移动 C.不移动 D.无法判断
8.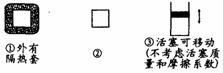 在右图所示的三个容积相同的容器①②③中均发生如下反应:
在右图所示的三个容积相同的容器①②③中均发生如下反应:
3A(g)+B(g) 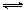 2C(g) ;△H<0
2C(g) ;△H<0
下列说法正确的是
A.若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③>②>①
B.若维持温度不变,起始时②中投入3 mol A、1 mol B;③中投入3 mol A,1 mol B和2molC,则达到平衡时,两容器中B的转化率②=③
C.若起始温度相同,分别向三个容器中充入1 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量一定相同
D.若起始温度相同,分别向三个容器中充入3a mol A和a mol B,则达到平衡时各容器中A物质的转化率一定相同
7. 可逆反应:2NO2(g)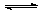 2NO(g)+O2(g)在定容密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n molO2的同时生成2 n molNO2
2NO(g)+O2(g)在定容密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n molO2的同时生成2 n molNO2
②单位时间内生成n molO2的同时生成2 n molNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③④⑤ B.②③⑤⑦ C.①④⑥⑦ D.全部
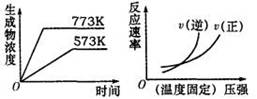
6. 下列反应中符合下图图象的是
A.N2(g) +3H2(g)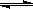 2NH3(g)
;△H=-Q1kJ·mol-1(Q1>0)
B.2SO3(g)
2NH3(g)
;△H=-Q1kJ·mol-1(Q1>0)
B.2SO3(g)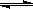 2SO2(g)+O2(g)
;△H=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g)
;△H=+Q2kJ·mol-1(Q2>0)
C.4NH3(g)+5O2(g)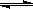 4NO(g)+6H2O(g);△H=-Q3kJ·mol-1(Q3>0)
D.H2(g)
+CO(g)
4NO(g)+6H2O(g);△H=-Q3kJ·mol-1(Q3>0)
D.H2(g)
+CO(g)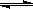 C(s)+H2O(g); △H=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g); △H=+Q4kJ·mol-1(Q4>0)
5.下列有关说法正确的是
A.SO2(g)+H2 O(g)=H2SO3(l),该过程熵值增大
B.SO2(g)= S(s)+O2(g); △H>0, △S<0,该反应能自发进行
C.3S(s)+2H2O(1)= SO2(g)+2H2S(g),室温下能自发进行
D.若某反应的△H<0,△S>0,则该反应一定能自发进行
4. 把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
A.盐酸的浓度 B.铝条的表面积
C.加少量Na2SO4固体 D.溶液的温度
3.对于双氧水的分解,下列说法正确的是
A.增大H2O2浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大
B.使用催化剂反应速率加快是因为正反应速率比逆反应速率快
C.催化剂不影响活化能但能增大单位体积内活化分子百分数,从而增大反应速率
D.升高温度能使反应速率增大,主要原因是增大了反应物分子中活化分子的百分数
2.下列实验操作中所用的仪器合理的是
A.用25 mL的碱式滴定管量取14.80 mL的KMnO4溶液
B.用100 mL的量筒量取5.2 mL盐酸
C.用托盘天平称取25.20 g氯化钠
D.用250mL的容量瓶配制所需的220mL 0.1mol·L-1的NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com