
题目列表(包括答案和解析)
1、石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的金刚石与石墨完全燃烧,放出的能量一样多
D.等质量的金刚石与石墨完全燃烧,石墨放出的能量多
26.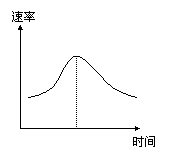 (6分)氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)
(6分)氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)
和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随
c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-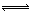 Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率下降的原因是
白云中学2009学年第二学期第一次月考
25.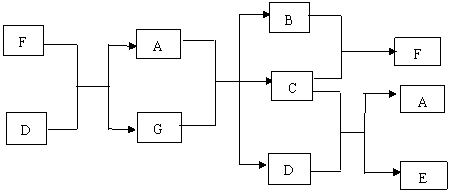 (13分)
(13分)
|
如图所示,已知G 、A分别是海水中含量最多的两种化合物,E是“84”消毒液的主要成分具有漂白性,请回答以下问题
(1)分别写出A、C、D、F、E的电子式:A 、C 、
D 、F 、E
(2)电解G 、A的混合物阴极上的电极反应式为
若同时在两电极附近各滴入几滴酚酞试液,阴极附近观察到的现象是 ;
阳极上的电极反应式为 ,检验该电极反应产物的方法是 。
(3)C和D反应可以生成一种强酸盐和生成一种弱酸盐写出方程式
该弱酸盐具有 性,常用于杀菌消毒。
24.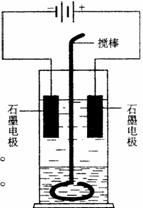 (10分)在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(10分)在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为________________________________。
(2)阴极上的电极反应式为________________________________。
(3)原上层液体是________________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是__________________。
23.(6分)从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是_______________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_____________________________。
22.(10分)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是
21.(5分)家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应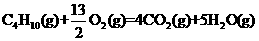 的ΔH为____________________。
的ΔH为____________________。
20. 以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是 ( )
A.8g B.16g C.32g D.64g
19.按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
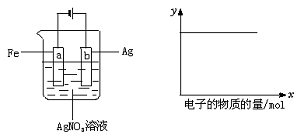
(1)c(Ag+)(2)c(NO3-)(3)a棒的质量 (4)b棒的质量(5)溶液的pH
A.(1)(3) B.(3)(4) C.(1)(2)(4) D.(1)(2)(5)
18.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e- =Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com