
题目列表(包括答案和解析)
7.用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是( )
A.HCl B.NaOH C.Na2SO4 D.NaCl
6.根据以下3个热化学方程式
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H=-Q1kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(1) △H=-Q2kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=-Q3kJ·mol-1
对Q1、Q2、Q3三者大小关系的判断正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
5.下列热化学方程式书写正确的是(△H的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) C.S(s)+O2(g)==SO2(g);△H=-296.8kJ/mol(反应热) D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
4.不能用勒沙特列原理解释的是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.加大压强更有利于合成氨
D.常温下,将1mL pH=3的醋酸溶液加水稀释至100mL后,测得其pH<5
3.下列电离方程式书写不正确的是( )

 A、2H2O H3O++OH-
B、H2S H++HS-
A、2H2O H3O++OH-
B、H2S H++HS-

 C、NaHS Na++HS-
D、HCO3-+H2O H3O++CO32-
C、NaHS Na++HS-
D、HCO3-+H2O H3O++CO32-
2. 下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池 B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能 D.锌锰干电池中,锌电极是负极
1.下列有关实验基本操作和实验现象的描述正确的是( )
A.用托盘天平称取25.20 g氯化钠
B.配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量
C.用玻璃棒蘸取溶液滴到湿润的pH试纸上,测其pH
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
24.(9分)一定温度下有反应2NO2(g)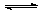 2NO(g)+O2(g) 。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
2NO(g)+O2(g) 。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
(1)用NO浓度表示的平均化学反应速率
(2)NO2的分解率
(3)该反应的平衡常数
23. Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是:
。
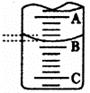
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是:
。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.32 |
25.34 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次, 其原因可能是 。 A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 C.第一次滴定用的锥形瓶用白醋润洗 D.该NaOH标准液保存时间过长,有部分变质,浓度降低 (4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简): c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
22.(6分)已知:相同温度时,一元弱酸HA的Ka比一元弱酸HB的Ka大。试比较相同温度相同体积的下列两溶液中离子数目的多少。(填“=”、“ >”、“<”、“无法确定”)
(1)物质的量浓度相等的NaA溶液(n1)与NaB溶液(n2),n1 n2
(2)pH相等的NaA溶液(n1)与NaB溶液(n2),n1 n2
(3)c(A-)与c(B-)相等的NaA溶液(n1)与NaB溶液(n2),n1 n2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com