
题目列表(包括答案和解析)
9、可以充分说明反应P(g)+Q(g)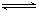 R(g)+S(g)在恒温下已达到平衡
R(g)+S(g)在恒温下已达到平衡
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
8、对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
7、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A. 加热 B.不用稀硫酸,改用98%浓硫酸
C. 滴加少量CuSO4溶液 D.不用铁片,改用铁粉
6、在密闭容器里,A与B反应生成C,其反应速率分别用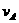 、
、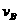 、
、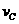 表示,已知2
表示,已知2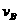 =3
=3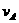 、3
、3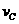 =2
=2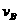 ,则此反应可表示为
,则此反应可表示为
A.2A+3B=2C B.A+3B=2C
C.3A+B=2C D.A+B=C
5、在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则该反应的平均反应速率为
A.0.4mol/(L·s) B.0.3mol/(L·s)
C.0.2mol/(L·s) D.0.1mol/(L·s)
4、已知在298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g) △H1 = -110.5kJ/mol C(s)+O2(g)=CO2(g), △H 2= -393.5kJ/mol 则C(s)+CO2(g)=2CO(g) 的△H 为
A.283.5kJ/mo B.172.5kJ/mol C. -172.5kJ/mol D.-504 kJ/mol
3、已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是:
A.H2O(g)=H2(g)+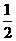 O2(g);
O2(g);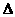 H= +242kJ·mol-1
H= +242kJ·mol-1
B.2H2(g)+O2(g)+2H2O(l);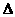 H= -484kJ·mol-1
H= -484kJ·mol-1
C.H2(g)+ O2(g)=H2O(g);
O2(g)=H2O(g);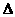 H= +242kJ·mol-1
H= +242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g);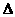 H= -484kJ·mol-1
H= -484kJ·mol-1
2、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
1、关于吸热反应的说法,正确的是
A.凡需加热的反应一定是吸热反应 B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应 D.酸碱中和反应的逆反应是吸热反应
29. 某研究性学习小组成员利用稀硫酸与某金属反应探究影响化学反应速率的因素,下表是研究过程中记录的实验数据:(表中某些数据记录已模糊不清,个别数据已丢失 ) (8分)
) (8分)
 实验 实验序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) /mol·L-1 |
v(H2SO4) /mL |
溶液温度/°C |
金属消失的时间/s |
|
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
数据模糊1 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
数据模糊2 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
数据丢失 |
44 |
40 |
若实验操作、数据记录均是正确的,请分析上述数据,回答下列问题:
(1)该实验主要是探究 、 、
等因素对反应速率的影响
(2)经仔细辨认,模糊的数据疑为25、125,试将这些疑似数据填入表中,使实验数据较为合理。数据模糊1 ,2 。
(3)试猜测实验9反应前溶液的温度约为 °C。
推测的依据是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com