
题目列表(包括答案和解析)
31.有pH为13的Ba(OH)2、NaOH的混合溶液100 mL,从中取出25 mL用0.025
mol/L H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:原混合溶液中Ba(OH)2的物质的量浓度
莆田一中2009-2010学年度下学期第一学段考试试卷答题纸
高二化学[选修4]
(完卷 120分钟 满分100分)
30.(9分)现有下列仪器或用品:
①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯(若干) ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:
(A)NaOH固体 (B)标准NaOH溶液 (C)未知浓度盐酸 (D)蒸馏水
(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是 (填编号)。
(2)配制250ml一定物质的量浓度的NaOH溶液时,还缺少的仪器是 。
(3)做酸碱中和滴定时,还缺乏的试剂是 。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的 (填编号)。
甲.酸式滴定管 乙.碱式滴定管
丙.25 mL量筒 丁.锥形瓶
(5)某同学用一份已知浓度的盐酸溶液滴定未知浓度的NaOH溶液,下列操作对滴定的结果有什么影响?(填“偏大”、“偏小”或“无影响”)
①酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗。_____________
②滴定前,滴定管尖端有气泡,滴定后气泡消失。_____________
③读酸式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数。_______④滴定到终点附近时,向锥形瓶中加入少量蒸馏水冲洗瓶壁上沾的溶液 _____
_____
29.(4分)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒醮取试样进行检测
(1)该学生的操作是 (填“正确的”或“错误的”)。
(2)如不正确请说明理由,同时请分析是否一定有误差?答:
(3)若按此法分别测定C(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是  K^S*5U.C
K^S*5U.C
28.(6分)求下列混合后溶液的pH:(lg2=0.3 lg5=0.7)
(1)把pH=2和pH=4的两种强酸溶液等体积混合,其pH=_______。
(2)把pH=12和pH=14的两种强碱溶液等体积混合,其pH=_________。
(3)把pH=2的H2SO4溶液和pH=10的NaOH溶液等体积混合,其pH=_______。
27.(8分)在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图所示)。容器中发生以下反应:N2+3 H2 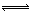 2
NH3(放热),若达到平衡后,测得混合气体的体积为7体积。据此回答下列问题: K^S*5U.
2
NH3(放热),若达到平衡后,测得混合气体的体积为7体积。据此回答下列问题: K^S*5U.
(1)保持上述反应温度不变,设a、b、c分别代表初始
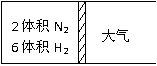 加入的N2、H2和NH3的体积,如果反应达到平衡时,各物质的百分含量和体积与上述平衡时完全相同,那么
加入的N2、H2和NH3的体积,如果反应达到平衡时,各物质的百分含量和体积与上述平衡时完全相同,那么
①若a=1,c=2,则b= 。在此情况下,反应起始时
将向
方向进行
②若需规定起始反应向逆方向进行,则c的范围是 。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是
理由是

25. (10分)完成以下小题:
(1)请完成下列各空:
①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式) K^S*5U.
26(8分)按要求完成下列化学反应式
(1)硫酸氢钠在水溶液中的电离方程式 ;
(2)Na2CO3溶液水解的离子方程式 ;
(3)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(4)Mg3N2与水反应的化学方程式 ;
24.室温时,将x mL pH=a 的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
第Ⅱ卷(非选择题,共52分)
23.草酸是二元中弱酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( ) K^S*5U.
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
22. 在10℃时某化学反应速率为0.1mol/(L·s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L·s),则该反应需在什么温度下进行( )
A.30℃ B. 40℃ C. 50℃ D. 60℃
21.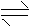 在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g) x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4
mol/L,下列有关叙述正确的是( ) K^S*5U.C
在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g) x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4
mol/L,下列有关叙述正确的是( ) K^S*5U.C
A.x值为2 B. 混合气体的密度增大
C.平衡时N的浓度为0.6 mol/L D. N的转化率为80%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com