
题目列表(包括答案和解析)
1、上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于…………………………( ) A、 无机物 B、 有机物 C、盐类 D、非金属单质
30.(10分)
I.
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核,通常状况下,W为无色液体,已知:X+Y Z+W。
Z+W。
(1)Y的电子式是______________________________。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________________。
II.
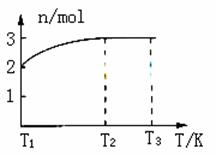
一定温度下,将1molN2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色,温度继续由T1升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化如图所示。
(1)温度在T1-T2之间,反应的化学方程式是___________________________。
(2)温度在T2-T3之间,气体的平均相对分子质量是______________(保留一位小数)。
长春市十一高中2009-2010学年度高二下学期期中考试
29.(14分)
A、B、C、D、E五种短同期元素,它们的原子序数依次增大。①A元素组成的单质是密度最小的物质;②B元素原子的最外层电子数是其内层电子总数的2倍;③D原子的电子层数与最外层电子数之比为3:1;④E元素的最外层电子数是其次外层电子数的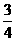 倍;⑤A、B、D、E四种元素,每一种均能与C元素形成原子个数比不相同的若干化合物。⑥甲、乙依次是D、E两种元素最高价氧化物对应的水化物。请回答下列问题:
倍;⑤A、B、D、E四种元素,每一种均能与C元素形成原子个数比不相同的若干化合物。⑥甲、乙依次是D、E两种元素最高价氧化物对应的水化物。请回答下列问题:
(1)写出B、C两种元素中,只由一种元素的原子构成的常见离子的符号: (至少两个)。
(2)反应快慢是化工生产考虑的重要因素。请选用以上元素组成的化合物,写出一个使用催化剂增大反应速率的工业生产实例: (用化学方程式表示)。
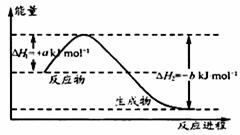 (3)BA4是一种重要能源物质,右图是1.01×105Pa下,
(3)BA4是一种重要能源物质,右图是1.01×105Pa下,
1 mol BA4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为: 。
(4)同时含有四种元素A、C、D、E的两种化合物彼此发生反应的离子反应方程式是 。
(5)常温,将一定浓度甲溶液逐滴加入到20.00mL 0.1mol/L的乙溶液中。
①若反应后混合溶液的pH如下表(设溶液混合后体积不变,且lg2=0.3),请填写空白:
|
实验编号 |
甲溶液的体积(mL) |
乙溶液的体积(mL) |
混合溶液的pH |
|
1 |
10.00 |
20.00 |
|
|
2 |
25.00 |
20.00 |
7.0 |
②为了准确测定甲溶液的浓度,可选 作为指示剂(填字母)。
A.酚酞 B.甲基橙 C.石蕊
(6)在标准状况下,若将11.2L气体BC2通入500mL 2mol/L的甲溶液中,反应后溶液中离子浓度由大到小的顺序是 。
28.(14分)
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
|
|
|||||||||||||||
|
|
|
|
|
G |
A |
I |
|
|
|||||||||
|
|
|
B |
|
|
|
C |
|
||||||||||
|
|
|
|
|
|
D |
E |
F |
|
|
H |
|
|
|
|
|
|
|
试回答下列问题:
(1)在一定条件下,A和C可形成一种化合物,常温下为淡黄色液体,则其固态时晶体类型为 , A和B形成的化合物具有高熔点和高硬度的特性,是一种新型无机材料,其晶体中所含的化学键类型为 。
(2)I的一种氢化物为10e-,则其VSEPR模型为_____________,中心原子的杂化类型为_______。
(3)元素G的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(4)D的基态原子的电子排布式为 ,E在形成化合物时它的最高化合价为_________。
(5)B单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如乙所示,原子之间相互位置关系的平面图如丙所示:
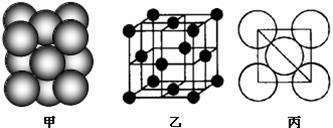
晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
27.(12分)
I.A-G是几种烃的分子球棍模型,据此回答下列问题:
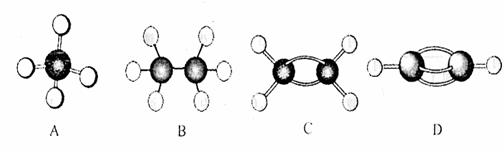
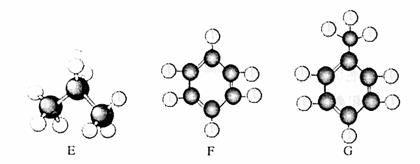
(1)常温下含碳量最高的气态烃是 (填对应字母)。
(2)在一定条件下,能与氢气发生加成反应的烃有 种(填数字)。
(3)写出实验室制取D的化学方程式 。
II.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为__________________。
(2)A的名称为______________________。
(3)A中的碳原子是否都处于同一平面?_________(填“是”或者“否”)。
(4)A是否存在顺反异构体?_________(填“是”或者“否”)。
26.(10分)元素A、B、C、D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与E的阳离子电子数相同。 |
原子核外电子占了4个原子轨道 |
最高价氧化物的水化物与其气态氢化物反应得到离子化合物E。 |
氧化物是一种耐火材料,能溶于A的最高价氧化物的水化物得到F。 |
(1)E中阳离子的电子式为 。
(2)写出D单质直接转化成F的离子方程式 。
(3)E的水溶液呈 (填“酸性”、“碱性”或“中性”),其原因用离子方程式表示为 。
(4)B元素最简单的氢化物分子为 分子(填“极性”或“非极性”)。已知,该氢化物和空气可作燃料电池,写出在碱性介质中该电池的负极的电极反应式 。
25.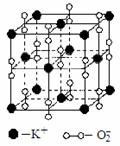 高温下,超氧化钾晶体呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是( )
高温下,超氧化钾晶体呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是( )
A.KO2中只存在离子键
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
D.晶体中与每个K+距离相等且最短的K+有12个
第Ⅱ卷
24.根据下表信息,判断以下叙述正确的是( )
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
23.下列是钠、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是( )
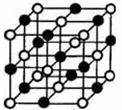
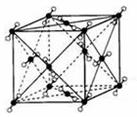
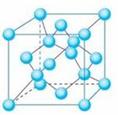
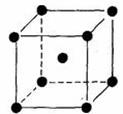
A. B. C. D.
22.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A.N3-与CO2含相等的电子数
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.HN3
的电离方程式为:HN3 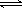 H++ N3-
H++ N3-
D.NaN3水溶液中离子浓度大小顺序为:c(Na+) >c(N3-) >c(OH-) >c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com