
题目列表(包括答案和解析)
4. 下列各组物质中,彼此之间关系正确的是( )
A.C(金刚石) 与 C(石墨) 属于同位素
B.CH2=CH2和CH2=CH-CH=CH2 属于同系物
 C.CH3COOH和C17H33COOH 不属于同系物
C.CH3COOH和C17H33COOH 不属于同系物
D.
3. 下列说法错误的是( )
A.石油裂化的主要目的是提高乙烯的产量和质量
B.石油主要是由烷烃、环烷烃、芳香烃组成的混合物
C.石油的催化裂解是工业生产乙烯的重要环节
D.通过煤的干馏可获得少量芳香烃
2. 下列化学用语正确的是( )
A.1,2-二溴乙烷的结构简式:C2H4Br2 B.羟基的化学式:OH-
C.己烷的分子式:C6H12 D.乙烯分子的最简式:CH2
1. 下列各组物质中,全部属于纯净物的是( )
A.草酸、白酒、醋 B.丙三醇、氯仿、乙醇钠
C.苯、汽油、无水酒精 D.蚁醛、冰醋酸、煤
21、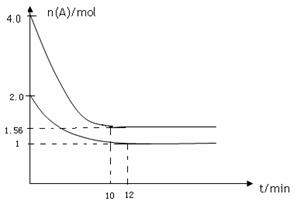 向容积均为2L的甲乙两个恒容容器中分别充入4moLA、4moLB和2moLA、2moLB,相同条件下发生反应:A(g)+B(g)
向容积均为2L的甲乙两个恒容容器中分别充入4moLA、4moLB和2moLA、2moLB,相同条件下发生反应:A(g)+B(g)  xC(g) ΔH < 0(x为整数)。测得两个容器中A的物质的量随时间t的变化情况如右图:
xC(g) ΔH < 0(x为整数)。测得两个容器中A的物质的量随时间t的变化情况如右图:
(1)甲容器中的反应速率比乙容器中的反应速率大的原因是
(2)该反应方程式中的x=
(3)反应达到平衡时,甲容器中A的速率VA=
(4)相同条件下,若起始是向容器中充入2moLC,达到平衡后, C的转化率为
。
20. 用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
|
|
NaOH起始读数 |
NaOH终点读数 |
|
第一次 |
0.10mL |
18.60mL |
|
第二次 |
0.30mL |
18.90mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
19.实验测得:0.5mol/LPb(NO3)2溶液的导电能力远远比同浓度的(CH3COO)2Pb溶液导电能力强。
(1)写出醋酸铅的电离方程式

 (2)PbSO4不溶于水和稀硝酸,但能溶于较浓的醋酸,得到无色透明的溶液,导电能力显著增强;向上述无色溶液中通入H2S气体,又生成黑色沉淀,溶液的导电能力稍有增强。请写出有关反应的离子方程式
(2)PbSO4不溶于水和稀硝酸,但能溶于较浓的醋酸,得到无色透明的溶液,导电能力显著增强;向上述无色溶液中通入H2S气体,又生成黑色沉淀,溶液的导电能力稍有增强。请写出有关反应的离子方程式
 并解释上述实验现象:
并解释上述实验现象:
 (3)上述实验中涉及的几种含铅化合物中,属于弱电解质的物质化学式是
(3)上述实验中涉及的几种含铅化合物中,属于弱电解质的物质化学式是
溶解度最小的物质化学式是

18. 对于2X(g) Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
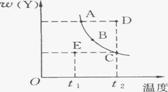
(1)该反应的正反应方向是一个 反应(填“吸热”或“放热”)。
(2)A、B、C、D、E各状态中,υ正<υ逆的是 。
(3)维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x y(填“<、>或=”)。
 (4)A.B.C三点平衡常数 (填相同.不相同)。最大的是 点。
(4)A.B.C三点平衡常数 (填相同.不相同)。最大的是 点。
17.①在常温下,已知醋酸的酸性大于次氯酸的酸性,等物质的量浓度的CH3COONa溶液和NaClO溶液,pH大的为:

 ②一元酸HA,一元碱NaOH.两者以等体积等浓度混合后溶液显碱性,溶液中离子浓度大小关系为:
②一元酸HA,一元碱NaOH.两者以等体积等浓度混合后溶液显碱性,溶液中离子浓度大小关系为:
③在相同的温度下,物质的量浓度相等的NH4Cl溶液和CH3COONH4溶液,铵根离子浓度大的为:
④氯化铝水溶液呈 性 ,
 原因是(用离子方程式表示):
原因是(用离子方程式表示):
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
⑤物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,醋酸体积 氢氧化钠溶液体积(填“大于.小于.等于”)。
16.在恒温、恒压下,反应N2 (g)+3H2 (g) 2NH3 (g)从两条途径分别建立平衡:
2NH3 (g)从两条途径分别建立平衡:
Ⅰ.N2、H2的起始浓度分别为1 mol / L和3 mol / L;
Ⅱ.NH3的起始浓度为4 mol / L。下列有关叙述不正确的是( )
A.途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同
B.途径Ⅰ的反应速率v (N2)与途径Ⅱ的反应速率v (NH3)的比值为1∶2
C.途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1∶2
D.途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com