
题目列表(包括答案和解析)
14、R3+的电子排布式为1s22s22p63s23p6,下列有关R的说法错误的是( 0.2 )
A.R原子的最外层有2个电子
B.R元素在元素周期表中所处的位置为d区,第4周期ⅢB族
C.价层电子排布为4s24p1
D.R原子的3d轨道上有1个未成对电子
13、最近科学家在实验室里成功地将CO2在高压下转化为类似SiO2的原子晶体。下列关于该CO2晶体的叙述中,不正确的是( 0.6 )
A.1mol该晶体含4molC-O单键
B.该晶体的熔、沸点高,硬度比SiO2晶体大
C.该晶体中C、O原子最外层都满足8电子稳定结构
D.该晶体中,C和O原子间存在π键
12、X、Y是第三周期主族元素,电负性:X>Y,下列说法错误的是( )
A.Y的气态氢化物的稳定性一定比X的差
B.Y的电离能一定比X的小
C.Y的最高价含氧酸的酸性一定比X的小
D.X与Y若形成化合物,X一定显负价
11、最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的分子式为( 0.85 ).
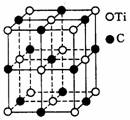
A.Ti14C13 B.Ti13C14
C.Ti4C7 D.TiC
10、向盛有硫酸铜水溶液的试管里加入少量氨水,开始生成浅蓝色的碱式硫酸铜沉淀[Cu2(OH)2SO4],继续加入足量氨水时,沉淀溶解得到深蓝色的铜氨溶液,若在该溶液中加入乙醇,即得到深蓝色晶体[Cu(NH3)4]SO4•H2O。下列说法不正确的是 ( )
A.在[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子
B.生成了深蓝色的[Cu(NH3)4]2+,[Cu(NH3)4]SO4在乙醇中的溶解度较小
C.碱式硫酸铜与氨水反应的离子方程式
Cu2(OH)2SO4 + 8NH3•H2O = 2[Cu(NH3)4]2+ + SO42- + 2OH- + 8H2O
D.深蓝色晶体中只含有离子键、配位键和氢键
9、关于杂化轨道的说法不正确的是( )
A.NH4+中N原子为sp3杂化,空间构型与CH4分子相同
B.BF3中B原子为sp2杂化,故BF3分子为平面三角形
C.BeCl2分子为直线形,所以推知BeCl2分子中Be为sp杂化
D.SO2是极性分子,所以推知SO2分子中S原子为sp3杂化
8、下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与苯 B.CCl4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
7、关于SiO2和CO2的说法正确的是 ( )
A. 碳原子和硅原子都采取sp3杂化
B. CO2分子是直线型结构,SiO2晶体是由共价键形成的空间立体网状结构
C. 干冰是分子晶体,CO2为极性分子
D. 二氧化硅晶体是原子晶体,它的分子式是SiO2
6、下表列出了有关晶体的知识,其中完全没有错误的是( )
|
|
A |
B |
C |
D |
|
晶体 |
硫化钾 |
干冰 |
金刚石 |
铝 |
|
组成晶体的微粒 |
K+、S2- |
CO2 |
C |
Al3+、e- |
|
晶体熔化时破坏的微粒间作用力 |
离子键 |
共价键、范德华力 |
共价键 |
金属键 |
|
物理性质 |
熔融时不导电 |
硬度小,沸点低 |
硬度大,熔点高 |
熔融时不导电 |
5、下列有关比较中,不正确的是( )
A.在水中的溶解性:NH3>CH4
B.碳碳键的键长:C2H4>C2H2
C.晶体熔点的高低:SiO2>CO2
D.晶格能的大小:NaF>MgO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com