
题目列表(包括答案和解析)
6.接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前没法进行综合利用。
(1)某硫酸厂每天排放的10000立方米尾气中含有0.2%(体积百分数)的二氧化硫,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100毫升2摩/升的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7克溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量最佳比值,从而提高亚硫酸氢钠的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且 =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式(不要求全部填满)。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式(不要求全部填满)。
|
x |
n(NaHSO3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[提示]:对于(2),先确定反应的产物是NaHSO3与Na2SO3的混和物,设这两种物质的物质的量分别是x、y,可列出下式:
 对于(3)可以运用分段讨论法,根据发生的反应,可确定
对于(3)可以运用分段讨论法,根据发生的反应,可确定 、
、 两个分界点,从而产生x£1、
两个分界点,从而产生x£1、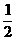 <x<1、x³1三个区域,然后再进一步讨论,最后可得:
<x<1、x³1三个区域,然后再进一步讨论,最后可得:
|
x |
n(NaHSO3) |
x£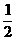 |
0 |
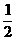 <x<1 <x<1 |
2n(SO2)-n(NaOH) |
|
x³1 |
n(NaOH) |
5.常温常压下,50毫升H2S与60毫升O2混和点燃充分反应后恢复到原状态,可生成SO2多少毫升?
[分析]:H2S燃烧的化学方程式有以下两种形式:
①氧气不足时:2H2S+O2
= 2S+2H2O
②氧气充足时:2H2S+3O2
= 2SO2+2H2O
因为 ,所以生成物中既有单质S,又有SO2存在。
[解一]:正向推导法
假如先发生反应①,则50毫升H2S中的S全部转变成单质S,同时消耗O225毫升,剩余的35毫升O2再与部分S发生反应S+O2 =
SO2,显然,当O2消耗完时,生成SO2的体积为35毫升。
[解二]:逆向推导法
假定先发生反应②,60毫升O2消耗完时可生成SO240毫升,同时消耗H2S40毫升,剩余10毫升H2S再与部分SO2发生反应2H2S+SO2
= 3S+2H2O,显然,该反应又消耗SO25毫升,则最后得到的SO2体积=40-5=35毫升。
[解三]:列方程组法
设发生反应①的H2Sx毫升,发生反应②的H2S为y毫升,据题意有:
,所以生成物中既有单质S,又有SO2存在。
[解一]:正向推导法
假如先发生反应①,则50毫升H2S中的S全部转变成单质S,同时消耗O225毫升,剩余的35毫升O2再与部分S发生反应S+O2 =
SO2,显然,当O2消耗完时,生成SO2的体积为35毫升。
[解二]:逆向推导法
假定先发生反应②,60毫升O2消耗完时可生成SO240毫升,同时消耗H2S40毫升,剩余10毫升H2S再与部分SO2发生反应2H2S+SO2
= 3S+2H2O,显然,该反应又消耗SO25毫升,则最后得到的SO2体积=40-5=35毫升。
[解三]:列方程组法
设发生反应①的H2Sx毫升,发生反应②的H2S为y毫升,据题意有:
 解得
解得 35毫升H2S按②式反应得到SO2的体积肯定是35毫升。
[解四]:直接配平法
分析题意可知,在反应过程中,H2S与O2两者均完全消耗完,所以可以用直接配平法进行解题:
50H2S+60O2
= 15S+35SO2+50H2O
上式表明:该反应中生成的SO2的体积为35毫升。
[解五]:差量法
H2S与O2反应生成液态水,无论发生反应①还是发生反应②,气体总体积的减少都是原H2S体积的
35毫升H2S按②式反应得到SO2的体积肯定是35毫升。
[解四]:直接配平法
分析题意可知,在反应过程中,H2S与O2两者均完全消耗完,所以可以用直接配平法进行解题:
50H2S+60O2
= 15S+35SO2+50H2O
上式表明:该反应中生成的SO2的体积为35毫升。
[解五]:差量法
H2S与O2反应生成液态水,无论发生反应①还是发生反应②,气体总体积的减少都是原H2S体积的 倍,本题中即减少50×
倍,本题中即减少50× =75毫升,由于最终剩余的气体只有SO2,所以SO2气体的体积=50+60-75=35毫升。
[解六]:十字交叉法
恰好发生不完全燃烧时O2与H2S的体积之比为
=75毫升,由于最终剩余的气体只有SO2,所以SO2气体的体积=50+60-75=35毫升。
[解六]:十字交叉法
恰好发生不完全燃烧时O2与H2S的体积之比为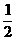 ,恰好发生完全燃烧时O2与H2S的体积之比为
,恰好发生完全燃烧时O2与H2S的体积之比为 ,本题中O2与H2S的体积比为,利用十字交叉法:
,本题中O2与H2S的体积比为,利用十字交叉法:

得发生反应①的H2S与发生反应② 的H2S的体积之比为 ,故发生反应②的H2S为50×
,故发生反应②的H2S为50× =35毫升,可知生成SO2的体积为35毫升。
[解七]:以50毫升H2S燃烧为基础作图:当O2为25毫升时开始生成SO2,当O2为75毫升时生成 SO2达到最大值(50毫升),从y轴中找到与x轴的“60”该值相对应的值是35,这说明生成SO2的体积为35毫升。
=35毫升,可知生成SO2的体积为35毫升。
[解七]:以50毫升H2S燃烧为基础作图:当O2为25毫升时开始生成SO2,当O2为75毫升时生成 SO2达到最大值(50毫升),从y轴中找到与x轴的“60”该值相对应的值是35,这说明生成SO2的体积为35毫升。

4.某空气污染监测仪是根据SO2和Br2的定量反应来监测空气中SO2含量的。其中Br2来自一个装满有酸性(H2SO4)溴化钾溶液的电解槽阳极上的氧化反应,电解槽阳极室与阴极室是隔开的。测某地区空气中的SO2含量时,空气经过机械除尘以1.5×10-4米3/分的流速进入电解槽的阳极室 ,电流计上测得每秒通过的电子是8.56×10-11摩,能保持溴浓度恒定并恰好与SO2完全反应,若被测空气中不含有其它与溴反应的物质: (1)写出监测过程中所发生的主要反就的化学方程式:

(2)计算该地区空气中SO2的含量(克/米3空气)[答:1.096×10-3克/米3]
3.将硫化氢和氧气的混和气体通入温度为220℃的密闭容器中,在高温下使之燃烧,反应后再恢复到原温度,测得此时容器中气体的压强比起始时减少28.6%。问:
(1)在容器中硫化氢发生的是完全燃烧还是不完全燃烧?
(2)原混和气体中硫化氢所占的体积百分数是多少?
[解]:如果反应完全按下式进行(氧气过量):
2H2S+3O2 == 2SO2+2H2O----① 则反应后的体积的减少量= <28.6%
<28.6%
如果反应完全按下式进行(硫化氢过量):
2H2S+O2 == 2S+2H2O---------② 则反应后的体积的减少量= >28.6%
>28.6%
由此可以推断题中给出的反应可能是①、②两反应的加合或者是只按反应②进行且硫化氢过量(说明:生成的硫单质在该温度下不是气体;)
现分两种情况加以讨论:
第一种情况:完全按反应②进行且硫化氢有剩余
设氧气为1体积,硫化氢为(2+a)体积(2体积参加反应,a体积剩余),则反应前气体的总体积为(2+a+1)由反应②可以知道,反应后气体体积为生成的水蒸气和剩余的硫化氢组成的混和物,其体积为(2+a),由题意可列出:
=71.4%=H2S%(说明:不用解出来,因为此表达式就是H2S%)
第二种情况:①、②两个反应同时进行,产物中既有S又有SO2,反应物没有剩余
设硫化氢为1体积,氧气为a体积,直接配平反应:
1H2S+aO2
==  S+
S+ SO2+1H2O
SO2+1H2O
由题意: 解得:a=1.8
解得:a=1.8
所以H2S%= =57.2%
=57.2%
2.焙烧1.10克黄铁矿,将形成的焙砂在氢气流中加热使其充分反.这样得到的物质在加热下用过量盐酸处理,向此溶液中加入双氧水并用氨饱和.定量地分离出形成的沉淀,将其溶解在盐酸中,加入过量的碘化钾.为了使得到的溶液褪色,准确地消耗了50升0.1摩/升的硫代硫酸钠溶液.
⑴写出所有的化学反应方程式
⑵计算黄铁矿中杂质的含量(假设所有反应都是定量进行的)
[解]:⑴4FeS2 +11O2 =2Fe2 O3 +8SO2
Fe2 O3 +3H2 =2Fe+3H2 O
Fe+2HCl=FeCl2 +H2 ↑
2FeCl2 +H2 O2 +4NH3 +4H2 O=2Fe(OH)3 ↓+4NH4 Cl
Fe(OH)3 +3HCl=FeCl3 +3H2 O
2FeCl3 +2KI=2FeCl2 +I2 +2KCl
I2 +2Na2 S2 O3 =Na2 S4 O6 +2NaI
⑵按反应I2+2Na2S2O3 =Na2S4O6 +2NaI可求得滴定碘时消耗了硫代硫酸钠的量为0 005摩.1摩硫代硫酸钠相当于1摩黄铁矿,因此,黄铁矿的量也是0.005摩(0.6克).杂质的含量为1.10-0.6=0.5克
杂质的百分含量为0.5/1.1=0.454即45.4%
0.2×0.5/V=0.2
解得V=0.5升(500升)
此时硫酸的总量应为0.5×2=1 摩
原先硫酸的量为0.2×1=0.2摩
需重新加入的硫酸量为1-0.2=0.8 摩
设需加入的硫酸体积为X 升
则有 1.35×X×55.8%=98×0.8
解得 X=104.1 升
1.现有硫酸和硫酸钠的混和溶液200升,其中硫酸的浓度为1摩/升,硫酸钠的浓度为0.5摩/升,要使硫酸和硫酸钠的浓度变为2摩/升和0.2摩/升,应加入55.8%的硫酸溶液(d=1.35 g/升)多少升后再加蒸馏水配制?
[解]:由于硫酸钠在配制前后总量没有发生变更,所以可根据最后它的浓度, 先求出最后溶液的体积V
17.
计 算 题
16.
某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、CuS、CdS含量各为2%
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再还原得粗锌:
2ZnS+O2 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 2CO
ZnO+CO
2CO
ZnO+CO Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
90年代生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
90年代生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
 试回答下列问题:
(1)软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S¯+2H2O,据此写出MnO2在酸性溶液中分别和CuS、FeS和CdS发生氧化-还原反应的化学方程式:
[答]:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S¯+2H2O
MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O
CdS+3H2SO4+MnO2=MnSO4+CdSO4+S¯+2H2O
软锰矿中Al2O3溶于硫酸的离子方程式:
[答]:Al2O3+6H+=2Al3++3H2O
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程
[答]:Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+
(3)产品C的化学式是[答:H2SO4]
(4)试从环境保护和能量消耗的角度评价90年代新工艺相比较有哪些优点。
[答]:从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。
试回答下列问题:
(1)软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S¯+2H2O,据此写出MnO2在酸性溶液中分别和CuS、FeS和CdS发生氧化-还原反应的化学方程式:
[答]:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S¯+2H2O
MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O
CdS+3H2SO4+MnO2=MnSO4+CdSO4+S¯+2H2O
软锰矿中Al2O3溶于硫酸的离子方程式:
[答]:Al2O3+6H+=2Al3++3H2O
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程
[答]:Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+
(3)产品C的化学式是[答:H2SO4]
(4)试从环境保护和能量消耗的角度评价90年代新工艺相比较有哪些优点。
[答]:从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。
15.将a摩H2S和1摩O2置于一个密闭容器中在120℃时反应,a的取值范围是[答: ];反应后生成SO2和H2O(气)的物质的量之和为[答:1+
];反应后生成SO2和H2O(气)的物质的量之和为[答:1+ ]摩。
[提示]:可采用直接配平法:
aH2S+O2=
]摩。
[提示]:可采用直接配平法:
aH2S+O2= SO2+
SO2+ S+aH2O
可见n(SO2)+n(H2O)=
S+aH2O
可见n(SO2)+n(H2O)= +a=1+
+a=1+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com