
题目列表(包括答案和解析)
2.下列有关有机物的说法错误的是 ( )
A.乙烯、氯乙烯都可通过加聚反应合成塑料
B.油脂、糖和蛋白质都能发生水解反应
C.只用Cu(OH):悬浊液就可鉴别乙醇、乙醛和乙酸
D.苯分子中所有的原子都在同一平面上
1.易燃、易爆、有毒等物质的包装上应贴L:危险警告标识。下面所列物质贴错了标识的是( )
|
|
A |
B |
C |
D |
|
物质的化学式 |
CCl4 |
NaOH |
CH3OH |
NH4NO3 |
|
危险警告标识 |
易燃品 |
腐蚀品 |
有毒品 |
爆炸品 |
21.(12分)本题为“物质结构与性质”选修模块的内容。
雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al ▲ Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: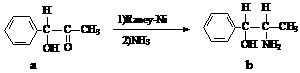
化合物b中进行sp3杂化的原子有: ▲ 。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: ▲ (选填序号)。

a.氯化钠 b.氯化铯 c.石英 d.金刚石
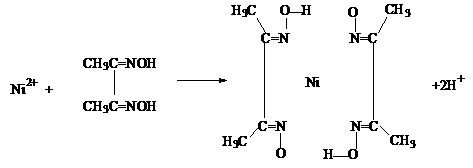
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为: ▲ 。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
20.(10分)分子筛可用于物质的分离提纯。某种型号的分子筛的工业生产流程可简单表示如下:
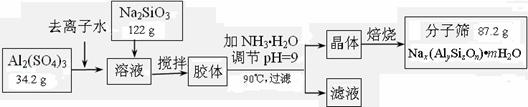
|
(1)在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
(2)生产流程中所得滤液的主要成分为 ▲ (写化学式)。
(3)假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%,试通过计算确定该分子筛的化学式(写出计算过程)。
(4)分子筛的孔道直径为4Å称为4A型分子筛;当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65Å)和异丁烷(分子直径为5.6Å)应该选用 ▲ 型的分子筛。
19.(14分)β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下:
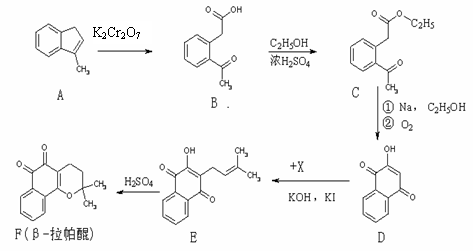

(1)已知X的分子式为C5H9Cl,则X的结构简式为: ▲ 。
(2)反应类型A→B ▲ 。
(3)上述反应中,原子利用率达100%的是 ▲ (选填:“A→B”、“B→C”、“D→E”、“E→F”)。
(4)D→E发生的是取代反应,还有一种副产物与E互为同分异构体,且属于醚类,该物质的结构简式为: ▲ 。
(5)化合物B的同分异构体很多,满足下列条件的同分异构体数目有 ▲ 种(不包括立体异构)。
①属于苯的衍生物 ②苯环上有两个取代基
③分子中含有一个手性碳原子 ④分子中有一个醛基和一个羧基
(6)已知:双烯合成反应: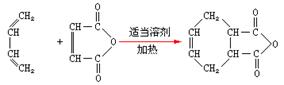 ,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
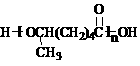 。
。
[提示]合成路线流程图示例如下:
18.(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4] ―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
[方法一]还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
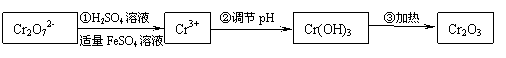

有关离子完全沉淀的pH如下表:
|
有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
|
完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 ▲ 。
(2)还原+6价铬还可选用以下的 ▲ 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为: ▲ (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 ▲ (填序号)最佳。
A.3-4 B.6-8 C.10-11 D.12-14
[方法二]电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式 ▲ 。
(5)电解法中加入氯化钠的作用是: ▲ 。
17.(8分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2
(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2
(l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是 ▲ 。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)
△H1
H2NCOONH4(氨基甲酸铵) (l)
△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)
△H2
H2O(l)+H2NCONH2(l)
△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,

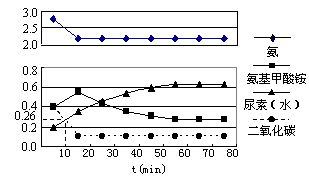
实验测得反应中各组分随时间的变化如下图Ⅰ所示:
图Ⅰ 图Ⅱ
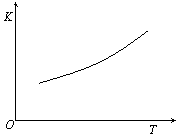
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲ 步反应决定,总反应进行到 ▲ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲ 0(填“>”“<”或“=”)
16.(10分)综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
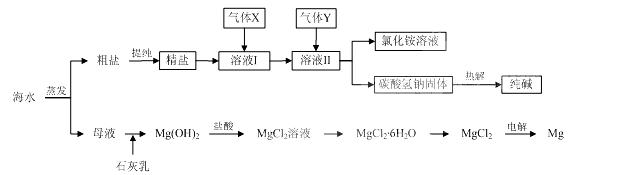
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤ ▲ ;⑥加适量的盐酸;⑦ ▲ 。
(2)溶液Ⅱ中发生反应的化学方程式是: ▲ 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用 ▲ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式 ▲ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为: ▲ 。
15.(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤ ▲ 。
⑥ ▲ 。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生: ▲ 。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是: ▲ 。
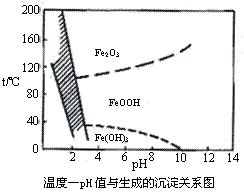 (3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2-4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。右图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。下列说法正确的是 ▲
(选填序号)。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2-4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。右图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。下列说法正确的是 ▲
(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85-95℃生成黄铁矾钢,此时水体的pH约为1.2-1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是: ▲ 。
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸)。
14.工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)
+ H2O(g)  CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
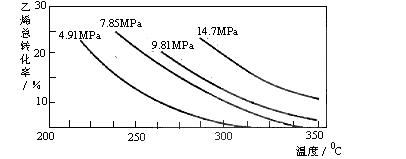
A.合成乙醇的反应一定为吸热反应
B.目前工业上采用250-300℃,主要是在此温度下乙烯的转化率最大
C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率
D.相同催化剂下,在300℃ 14.7MPa乙醇产率反而比300℃ 7MPa低得多,是因为加压平衡向逆反应方向移动
第II卷(共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com