
题目列表(包括答案和解析)
6.不溶于水的氧化亚铜,可溶于含有硫酸的硫酸铁溶液,发生的反应为: Cu2O+Fe2(SO4)3+H2SO4 = CuSO4+FeSO4+H2O 反应中生成的硫酸亚铁可用高锰酸钾的硫酸溶液滴定,发生的反应为: FeSO4+KMnO4+H2SO4 = K2SO4+MnSO4+Fe2(SO4)3+H2O 用以上方法可测得氧化亚铜的量。 (1)配平以上两个反应方程式: [答: Cu2O+Fe2(SO4)3+H2SO4 = 2CuSO4+2FeSO4+H2O 10FeSO4+2KMnO4+8H2SO4 = K2SO4+2MnSO4+5Fe2(SO4)3+8H2O]
(2)400毫克氧化亚铜样品中生成Fe2+可被1毫升1摩/升的高锰酸钾溶液刚好滴定,则样品中Cu2O的百分含量是多少(设样品中含有的是惰性杂质)[答:90%]
5.今有A、B两个试管,A试管装有用硫酸酸化的高锰酸钾溶液,B试管装有亚硫酸溶液.实验发现,将少量的A液滴入B液中和将少量的B液滴入A液中现象不同.
试解释之.
[解释]:① 将少量的A液滴入B液中时,高锰酸钾不足,而还原剂(亚硫酸)过量,反应的结果是高锰酸钾溶液的颜色完全褪去:
KMnO4 +5H2SO3 =2MnSO4 +K2SO4 +2H2SO4 +3H2O
② 将少量的B液滴入A液中时,高锰酸钾过量,+7价的Mn元素不能完全被还原成+2价,最后溶液中将出现不溶物(MnO2)
a: 2KMnO4 +5H2SO3 =2MnSO4 +K2SO4 +2H2SO4 +3H2O
b: 2KMnO4 +3MnSO4 +2H2O=5MnO2 +2H2SO4 +K2SO4
将a、b两式合并,可得:
2KMnO4 +3H2SO3 =2MnO2↓+2H2SO4 +K2SO4 +H2O
4.Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu和Cu2+,现只有浓硫酸,浓硝酸,稀硫酸,稀硝酸,氯化铁稀溶液及PH试纸,简述如何用最简便的方法来检验氧化铜经氢气还原所得的红色物质中是否含有碱性氧化物Cu2O?
[分析]:用稀硫酸溶解红色物质,再根据溶液是否呈蓝色得出结论.
不能用题中给出浓酸,因为它们有强氧化性,不管有无Cu2O,均能生成蓝色溶液,也不能用氯化铁溶液,因为它能与铜反应生成正二价的铜离子而也使溶液呈蓝色,干扰检验.
3.在KI和H2SO4 溶液中加入H2O2 ,放出大量不溶于水的无色气体(气泡从溶液内部放出),同时溶液呈紫红色,且可使淀粉变蓝,写出化学方程式.
[分析]:这是一道颇为简单但却很容易出错的化学题,错误的原因大多是把实验现象看成只是一个反应的现象,其实,实验现象往往是若干个反应共同体现出来的,该题就是如此.有的同学认为产物中有I2 和O2 ,这没有错,但如果认为这两种物质均是由一个反应得到的话,这就错了,因为在这个反应中,这两种物质均是氧化产物,哪么还原剂是什么呢?如果还原剂是H2SO4 ,则应该有SO2生成,与题意不符,而且稀H2SO4 也没有这么强的氧化性.
H2O2 +2KI+H2SO4 =I2 +K2SO4 +2H2O
2H2O2 =2H2O+O2 ↑
2.为研究第VIII族元素的性质递变规律,现取两只试管,在试管①中盛Fe(OH)3,在试管②中盛Co(OH)3,向两支试管中各加入浓盐酸,并在试管口放湿润的KI淀粉试纸,结果发现试管①中沉淀溶解,试管口试纸不变色;试管②中沉淀溶解,且试管口试纸变蓝色,根据上述实验,可推知:Fe3+的氧化性比Co3+的氧化性[答]:弱(强或弱);有关反应的离子方程式为:
[答]:Fe(OH)3+3H+ == Fe3++3H2O 2Co(OH)3+6H++2Cl- == 2Co2++Cl2+6H2O
Cl2+2I- == I2+2Cl- 。
1.一个完整的氧化-还原反应式可以折写成两个“半反应”,一个是氧化反应,另一个是还原反应;如2Fe3++Cu=2Fe2++Cu2+拆写的结果是:氧化反应:Cu-2e=Cu2+;还原反应:Fe3++e=Fe2+,据此,请将反应3NO2+H2O=2H++2NO3-+NO拆写成两个“半反应”式:
[答]:氧化反应:H2O+NO2-e=NO3-+2H+
还原反应:2H++NO2+2e=NO+H2O
21.
保险粉是连二亚硫酸钠(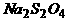 )的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入
)的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入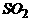 气体,所发生的化学反应是:HCOONa+2
气体,所发生的化学反应是:HCOONa+2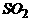 +NaOH=
+NaOH=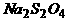 +
+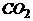 +
+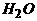 ,以下有关叙述中错误的是--------------------------------------------------------------------------------[B]
A、在此反应中,HCOONa是还原剂,
,以下有关叙述中错误的是--------------------------------------------------------------------------------[B]
A、在此反应中,HCOONa是还原剂,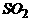 是氧化剂
B、保险粉的还原性比HCOONa的还原性强
C、NaOH未被氧化也未被还原
D、甲醇虽未参加反应,但有助于保险粉的结晶、分离
是氧化剂
B、保险粉的还原性比HCOONa的还原性强
C、NaOH未被氧化也未被还原
D、甲醇虽未参加反应,但有助于保险粉的结晶、分离
填 空 题
20.
已知IBr的性质与卤素相似,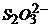 的结构为
的结构为 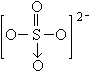 ,
, 的结构为
的结构为 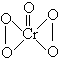 ,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是-------------------------------------------------------------------------------------------------[D]
①IBr+
,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是-------------------------------------------------------------------------------------------------[D]
①IBr+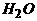 =HIO+HBr ②
=HIO+HBr ②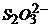 +2
+2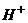 =S¯+
=S¯+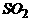 +
+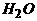 ③
③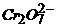 +4
+4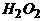 +2
+2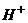 =2
=2 +5
+5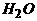 ④ 2HOF=2HF+
④ 2HOF=2HF+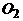 A、①②③④ B、只有②③④ C、只有④ D、只有②
A、①②③④ B、只有②③④ C、只有④ D、只有②
19.
检验NO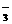 的方法是:在试液中加入饱和
的方法是:在试液中加入饱和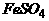 溶液摇匀,将试管倾斜成45°左右,沿管壁缓慢加入硫酸,静置片刻,在两液体的界面上有棕色环产生,这种棕色环的主要成份是---------------------------------------------------------------[B]
A、
溶液摇匀,将试管倾斜成45°左右,沿管壁缓慢加入硫酸,静置片刻,在两液体的界面上有棕色环产生,这种棕色环的主要成份是---------------------------------------------------------------[B]
A、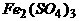 B、Fe(NO)SO4
C、Fe(NO2)SO4 D、Fe(OH)SO4
B、Fe(NO)SO4
C、Fe(NO2)SO4 D、Fe(OH)SO4
18.
将两种硫酸盐按一定质量比混和后制得化合物W,已知W溶于水可电离出K+、Cr3+和SO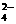 。现将2.83克W中的Cr3+全部氧化成为Cr2O
。现将2.83克W中的Cr3+全部氧化成为Cr2O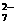 后,这些Cr2O
后,这些Cr2O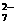 再和过量的KI溶液反应得到3.8克I2(Cr2O
再和过量的KI溶液反应得到3.8克I2(Cr2O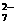 +6I-+14H+=2Cr3++3I2+7H2O);另取2.83克W投入到过量的BaCl2溶液中,得到4.66克白色沉淀,由此判断W的化学式为----------------------------------------------[D]
A、K2Cr(SO4)3 B、K3Cr2(SO4)3
C、KCr3(SO4)3 D、KCr(SO4)2
+6I-+14H+=2Cr3++3I2+7H2O);另取2.83克W投入到过量的BaCl2溶液中,得到4.66克白色沉淀,由此判断W的化学式为----------------------------------------------[D]
A、K2Cr(SO4)3 B、K3Cr2(SO4)3
C、KCr3(SO4)3 D、KCr(SO4)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com