
题目列表(包括答案和解析)
9.
计 算 题
8.
下图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
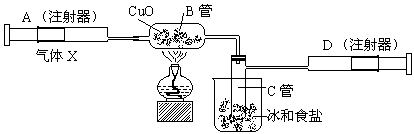 在注射器A中装有240毫升气体X慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32克,实验后B管重20.00克,B管中的黑色粉未变成红色粉未。
在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由 和 元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩X气体的体积是24000毫升,则X的摩尔质量是
克/摩。
(3)通过计算,确定X的分子式为
。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)
[答]:(1)氮、氢(2)32(3)N2H4
(4)N2H4+2CuO
在注射器A中装有240毫升气体X慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32克,实验后B管重20.00克,B管中的黑色粉未变成红色粉未。
在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由 和 元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩X气体的体积是24000毫升,则X的摩尔质量是
克/摩。
(3)通过计算,确定X的分子式为
。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)
[答]:(1)氮、氢(2)32(3)N2H4
(4)N2H4+2CuO N2+2H2O+2Cu
N2+2H2O+2Cu
7.测得某硫酸铁溶液中,水分子与Fe3+的个数比为100:1,则该溶液的溶质质量分数为[答:10%]
[提示]:相当于200摩尔H2O溶解了1摩尔Fe2(SO4)3,所以有:
Fe2(SO4)3%=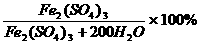 =
=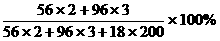 =10%
=10%
5.4℃时,a(a为一个巨大数)个水分子所占体积约为[答: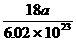 ]毫升。
[提示]:a个水分子为
]毫升。
[提示]:a个水分子为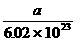 摩尔,质量为
摩尔,质量为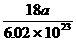 ×18克,在4℃时,其质量(克)在数值上等于其体积(毫升)。
6.血红蛋白(分子量为M)中,铁元素(原子量为A)的质量百分比含量为x%。一个血红蛋白分子中含有[答:
×18克,在4℃时,其质量(克)在数值上等于其体积(毫升)。
6.血红蛋白(分子量为M)中,铁元素(原子量为A)的质量百分比含量为x%。一个血红蛋白分子中含有[答: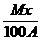 ]个铁原子。
[提示]:1摩尔血红蛋白质量为M克,其中含铁质量为M·x%,含铁的物质的量为
]个铁原子。
[提示]:1摩尔血红蛋白质量为M克,其中含铁质量为M·x%,含铁的物质的量为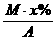 摩尔,所以一个血红蛋白分子含铁原子
摩尔,所以一个血红蛋白分子含铁原子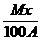 个。
个。
4.为方便某些化学计算,常将98%的浓硫酸表示为硫酸水合物的形式(H2SO4·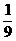 H2O)或三氧化硫水合物的形式(SO3·
H2O)或三氧化硫水合物的形式(SO3·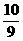 H2O),则98%的浓磷酸表示为磷酸水合物的形式是[答:H3PO4·
H2O),则98%的浓磷酸表示为磷酸水合物的形式是[答:H3PO4·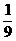 H2O],表示为五氧化二磷水合物形式是[答:P2O5·
H2O],表示为五氧化二磷水合物形式是[答:P2O5·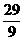 H2O或9P2O5·29 H2O]
H2O或9P2O5·29 H2O]
3.实验室用二氧化锰与氯酸钾混和加热制取氧气时,有时可闻到有刺激性气味,这是因为过程中有少量的氯酸钾与二氧化锰反应生成了高锰酸钾、氯气和氧气。 (1)写出上述反应的化学方程式 [答:2MnO2+2KClO3 == 2KMnO4+Cl2+O2]
(2)若在上述反应中有3摩电子转移,则生成了[答:0.3]摩氯气 (3)若所得气体在同温同压下对氢气的相对密度是16.0875,则在混和物中,按上式反应的氯酸钾的质量占反应掉的氯酸钾的总质量的[答:1.34%]
2.金属A和非金属B可直接化合生成化合物AB。甲、乙、丙三人分别做A和B化合生成AB的实验,每人所用A和B的质量互不相同,但A和B的总质量都是9克。甲用7克A和2克B充分反应后制得AB6克;乙用4克A和5克B也制得AB6克;丙制得AB4.44克。试通过计算和分析,确定丙用了多少克A和多少克B?
[提示]:通过甲、乙两人的实验可知,4克A与2克B正好完全反应生成6克AB,也就是说,在产物AB中,A的质量占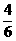 ,B的质量占
,B的质量占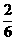 所以在4.44克AB中,A的质量=4.44×
所以在4.44克AB中,A的质量=4.44×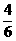 =2.96克
B的质量=4.44×
=2.96克
B的质量=4.44×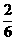 =1.48克
故当A过量时,丙取用的B=1.48克,A=9-1.48=7.52克
当B过量时,丙取用的A=2.96克,B=9-2.96=6.04克
=1.48克
故当A过量时,丙取用的B=1.48克,A=9-1.48=7.52克
当B过量时,丙取用的A=2.96克,B=9-2.96=6.04克
1.4毫升O2和3毫升NxHy(y>x)混合气体在120℃,1.01×105Pa下点燃完全反应后,恢复到原温度和压强时,测得反应后N2、O2、H2O(气)混合气体密度减小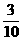 。
(1)反应的化学方程式为[答: 4NxHy+yO2 ¾® 2xN2+2yH2O]
(2)推算NxHy的分子式:
计算的根据是(用文字叙述)[答:反应前后质量守恒,同温同压下气体密度与气体体积成反比],即(用含x、y的代数式表示)[答:
。
(1)反应的化学方程式为[答: 4NxHy+yO2 ¾® 2xN2+2yH2O]
(2)推算NxHy的分子式:
计算的根据是(用文字叙述)[答:反应前后质量守恒,同温同压下气体密度与气体体积成反比],即(用含x、y的代数式表示)[答: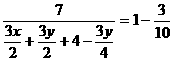 ],解此方程得[答:x=2,y=4]时符合题意,所以NxHy的分子式为[答: N2H4]
],解此方程得[答:x=2,y=4]时符合题意,所以NxHy的分子式为[答: N2H4]
27.
填 空 题
26. 1.92 克铜与过量的浓硝酸反应,收集到1.12升气体(折算成标准状况),则被还原的硝酸的物质的量是---------------------------------------------------[B] A、0.05摩 B、0.06摩 C、0.02摩 D、0.07摩 [提示]:要按铜的量计算,不要在意“1.12”
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com