
题目列表(包括答案和解析)
9.
把11.9gH2S和11.2升(标准状况)O2,在一密闭容器中混和,在一定条件下充分反应后,测知反应物无剩余,再回复到原来状况,则容器中氧化产物的总质量是--------------------------------------------(C)
(A)10.8g (B)11.2g (C)21.6g (D)22.4g
[提示]: H2S和O2的反应可能有两种情况(反应式略),氧化产物可能是硫或二氧化硫或这两者的混和物。由氢元素的质量守恒有:水的质量=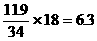 g,则氧化产物的质量=11.9+
g,则氧化产物的质量=11.9+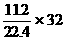 -6.3=21.6g。
-6.3=21.6g。
8. 磷和氧气的反应,在两个容器中分别控制不同条件按如下两种形式进行反应: P4+3O2 == 2P2O3 P4+5O2 == 2P2O5。若在两容器中分别放入1mol磷和1mol氧气,经充分反应,分别得到P2O3 与P2O5的物质的量之比为------(C) (A)1:1 (B)2:1 (C)5:4 (D)5:3 [提示]: 这里没有指明是白磷还是红磷,不过这不要紧,只要前后一致就行,这道题的关键问题是当这两种物质反应时,生成P2O3时氧气过量,所有的磷全部反应,而生成P2O5时磷过量,磷不能完全参与反应。
7. 已知白磷与氧气可发生如下反应:P4+3O2 == P4O6 P4+5O2 == P4O10,现在某密闭容器中加入62g白磷和50.4升氧气(标准状况),使之恰好完全反应,则所得到的P4O10与P4O6的物质的量之比为---(C) (A)1:3 (B)3:2 (C)3:1 (D)1:1 [提示]:由题给的物质的量,采用直接配平法:2P4+9O2=xP4O10+yP4O6,再根据质量守恒求得x=1.5,y=0.5。
6.
t℃时,在100g水中加入w1克无水硫酸锌或加入w2克皓矾晶体,都可使溶液达到饱和状态,则w1与w2的关系符合于------------------------------------[B]
(A)w1=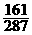 w2
(B)w1=
w2
(B)w1=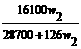 (C)w1=
(C)w1=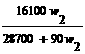 (D)w1=
(D)w1=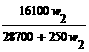 [提示]: 两者均在100g水中形成饱和溶液,则溶液中溶剂与溶质的比例相等,也就是:100:W1=(100+W2×
[提示]: 两者均在100g水中形成饱和溶液,则溶液中溶剂与溶质的比例相等,也就是:100:W1=(100+W2×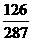 ):W2×
):W2×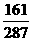
5. 298K时,向V升真空容器中通入nmolSO2和mmolH2S。若5n=m,且反应后氧化产物与还原产物的质量和为48g,则n与m之和为--------------(C) (A)1 (B)2 (C)3 (D)4 [提示]:硫化氢过量1.5mol
4. 工业上从含硒废料中提取硒的方法是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸即转化为亚硒酸(2HCl+H2SeO4 = H2SeO3+Cl2+H2O),再通入SO2于亚硒酸的溶液中,单质硒柝出,据此下列叙述正确的是---------------------------------------------------------------------(AB) (A) H2SeO4的氧化性强于Cl2 (B)亚硒酸的氧化性强于亚硫酸 (C)SeO2还原性强于SO2 (D)柝出1mol尔硒,1mol尔SO2
3. 为除去SO2中混有的少量SO3,并使所得物质的平均相对分子质量尽可能地增大,应选用的物质是-(D) (A)亚硫酸钠溶液 (B)亚硫酸氢钠溶液 (C)碱石灰 (D)浓硫酸 [提示]:浓硫酸与SO3生成H2SO4·nSO3
2. 用足量的氢气和氧气分别跟mg硫反应,并将生成物混和,可生成的硫为 (B) (A)2mg (B)1.5mg (C)mg (D)0.5mg
1. 常温下,向20升真空容器中通入amol尔硫化氢和bmol尔氯气(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最大密度是------------------------------------------------------(B) (A)19.45g/L (B)18.25g/L (C)17.85g/L (D)35.5g/L [提示]:氯气在与硫化氢反应时,不管氯气过量与否,其中的氯元素始终存在于气体中,当氯化氢取最大值(b=5)时才符合题意,同时,考虑到与氯元素结合的氢越多,气体的质量也越大,密度值也越大,所以硫化氢在允许的前提下也是越大越好(a=5),可求得此时气体的密度为18.25g/L,答案为B。如果反过来考虑:硫化氢中的氢元素也始终存在于气体中,硫化氢理当取最大值,氯元素的量也应该最大,同样也可推得答案为(B)[经计算,当a:b的值为1:5.45(不是正整数,不符合题意)时,为A; 当a:b的值为5:5时,为B; 当a:b的值为1:5时,为C; 当a:b的值为0:n时(此时不是混和气体,全是氯气,已不符合题意),气体的密度为17.75g/L,所以D是无论如何也达不到的.
15. [AC]将等物质的量浓度等体积的H2SO4溶液分装在五个烧杯中,然后分别加入下列物质,充分反应后,所得硫酸镁溶液物质的量浓度相等的是①镁粉 ②氧化镁 ③氢氧化镁 ④碳酸镁 ⑤硫化镁 (A)①和⑤ (B)①和② (C)②和④ (D)③和④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com