
题目列表(包括答案和解析)
20. (6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
|
实验室制取Cl2的原理是:MnO2 + 4HCl(浓) === MnCl2 + 2H2O + Cl2↑
(1)从下图中挑选所需仪器,画出收集纯净干燥Cl2的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
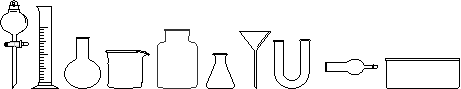
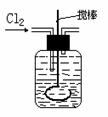 (2)将氯气通入盛有两种互不相溶的中性液体的容器中,如下图所示。当Cl2通入后,上层液体呈现棕色,且颜色由浅变深,然后用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(2)将氯气通入盛有两种互不相溶的中性液体的容器中,如下图所示。当Cl2通入后,上层液体呈现棕色,且颜色由浅变深,然后用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
①上层液体通入Cl2后发生的离子反应方程式是________。
②原上层液体是________________。
③原下层液体是________________。
④上下剧烈搅动的目的是____________________________。
⑤要检验上层液体中含有的金属离子,其方法是________,现象是_______。
⑥实验结束后,若要将两种液体分离,要用到的玻璃仪器是_______。
19. 已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B. c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C. c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D. c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
第Ⅱ卷(非选择题,共83分)
18.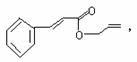 对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
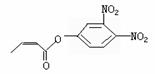
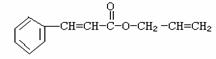 可简化为
可简化为
杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下
能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色 B.均能发生银镜反应
C.均能与溴水发生反应 D.均能与NaOH溶液发生反应
17.将2.4 g Fe 、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体V L(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6 g。则收集到的气体体积V值可为
A.0.986 B.1.12 C.3.36 D.6.72
16.下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A.O3+2KI+H2O==2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C.I2+2NaClO3==2NaIO3+Cl2
D.4HCl+MnO2==MnCl2+Cl2↑+2H2O
15.下列各种溶液中,一定不能大量共存的离子组是
A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离的c(H+)=10-14mol·L-1 的溶液中:K+、Na+、Ca2+、HCO3-
C.含有大量Fe3+的溶液中:Mg2+、Al3+、Cu2+、SO42-
D.使紫色石蕊试液变蓝色的溶液中:Na+、AlO2-、S2-、SO42-
14.类推的思维方法在化学学习和研究中常回产生错误的结论,因此类推出的结论要经过实践的检验才能决定其正确与否.下列几种类推结论中不正确的是
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4可写成PbO·Pb2O3
C.能用电解熔融MgCl2来制取金属镁,也能用电解熔融AlCl3来制取金属铝;
D.Fe与S直接化合生成FeS;Al与S直接化合也可以生成Al2S3
13.下列离子方程式中,正确的是
A. 氢氧化铝与足量盐酸反应 Al(OH)3 + 3H+ = Al3+ + 3H2O
B. NH4HCO3和足量NaOH溶液相混合 HCO3- + OH- = CO32- + H2O
C. 大理石溶解于醋酸 CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
D. 过量CO2通入氢氧化钠溶液中 CO2 + 2OH- = CO32- + H2O
12. 等体积的0.2 mol·L-1的CH3COOK溶液与0.1 mol·L-1盐酸混合后,溶液中下列微粒的物质的量浓度关系中正确的是
A. c(CH3COO-)+ c(OH-)+ c(Cl-)= c(H+)+ c(K+)
B. c(CH3COO-)> c(Cl-)> c(H+)> c(CH3COOH)
C. c(CH3COO-)= c(Cl-)= c(H+)> c(CH3COOH)
D. c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+)
11.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.C1-离子一定不存在 D.不能确定HCO3-离子是否存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com