
题目列表(包括答案和解析)
21.(8分)根据溴的性质,填写下列表格中关于液溴保存方法的选择及有关原因的解释:
①广口瓶②细口瓶③玻璃塞④橡皮塞⑤水封⑥煤油封⑦棕色瓶⑧无色瓶
|
|
选择保存方法 |
解释 |
|
(1) |
|
|
|
(2) |
|
|
|
(3) |
|
|
|
(4) |
|
|
20. 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距离为a cm,氯化铯的式量为M,NA为阿氏常数,则氯化铯晶体的密度为
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距离为a cm,氯化铯的式量为M,NA为阿氏常数,则氯化铯晶体的密度为
|
|
|
|
A.-- g/cm3 B.-- g/cm3 C.-- g/cm3 D.-- g/cm3
19.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中7.5mol CuSO4可氧化的P原子的物质的量为
A.1.5mol B.5.5mol C.3mol D.2.5mol
18.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为
1mol·L-,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为
A.89.6mL B.112mL C.168mL D.224mL
17.下列实验测量数据记录正确的是
A.用pH试纸测得0.100mol/mol醋酸的pH为3.02
B.用量筒测得排水法收集制得的氢气体为50.28mL
C.用滴定管测得中和滴定所消耗的标准溶液体积为20.32mL
D.用托盘天平称得2.50g胆矾受热充分失水后,固体质量减轻0.90g
16.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3-+2OH-====CaCO3↓+ 2H2O + CO32-
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液:
2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
15.从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
② 将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
14.A、B、C均为短周期元素,A、B同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
13. 设NA表示阿伏加德罗常数,下列叙述中正确的是 :
A.常温常压下,11.2 L氧气所含的原子数为NA
B.1.8 g的 中含有的电子数为NA
中含有的电子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.常温常压下1 mol NO2气体与水反应生成NA个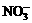 离子
离子
12.根据热化学方程式:S(s)+O2(g) = SO2(g);△H=-297.23 kJ/mol ,下列说法正确是:
A.1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和
B.1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和
C.S(g)+O2(g) = SO2(g);△H= -Q kJ/mol ; Q的值大于297.23
D.S(g)+O2(g) = SO2(g);△H= -Q kJ/mol ; Q的值等于297.23
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com