
题目列表(包括答案和解析)
3.下列各项中表达正确的是
A.F原子结构示意图: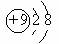 B.CO2的分子模型:
B.CO2的分子模型:
C.HCl的电子式为: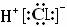 D.NH3的结构式:
D.NH3的结构式: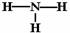
2.教材是学习的重要材料,但不能迷信教材。下列是中学化学教材中摘录的部分表述内容,根据你所学的化学知识判断,其中不够科学严密的是
A.第三册教材P20:除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚沉。
B.第一册教材P17:离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。
C.第一册教材P101:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
D.第二册教材P34:不同的化学反应,具有不同的反应速率,这说明,参加反应的物质的性质是决定化学反应速率的重要因素。
1.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的核素-30P,开创了人造核素的先河。其发生的变化可表示如下:27Al+4He→30P+1n。下列有关说法不正确的是
A.30P和 31P 两种核素互为同位素
B.该变化同样遵循质量守恒定律
C.该变化说明原子核在化学反应中也能发生变化
D.在30P中存在:质子数=中子数=核外电子数
32.钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5 g (相当于钙元素600 mg),成人每天服用1片。”
(1) “1.5 g碳酸钙与600 mg的钙”的计量关系是如何得出来的,请列式并计算表示
(2) 该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下实验:取10片该片剂碾碎后放入足量的HCl中经充分反应(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加(NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1 L溶液,取其20.0 mL,然后用0.0500 mol/LKMnO4 溶液滴定,反应中用去12 .0 mL KMnO4溶液,发生的离子反应为:
2MnO4― +5H2C2O4 +6H+ 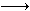 2Mn2+ +10CO2↑+8H2O
2Mn2+ +10CO2↑+8H2O
① 请通过计算回答该片剂中碳酸钙的含量。
② 参照上述关于“钙尔奇D600片剂”的文字说明,你认为该片剂的名称应该叫“钙尔奇D________ 片剂”。
31.合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1) 某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为___________。
(2) 当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为_____________(用小数表示,保留2位小数)。
(3) 以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2 Fe2O3十C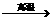 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_________g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_________g。
30.硫化氢是一种无色有腐蛋臭味的气体,常温下1个体积水可溶解2.6个体积的硫化氢。某研究性学习小组进行H 2S的制备及性质探究实验,根据反应原理:
 FeS(固)+ H2SO4(稀)
FeSO4 + H 2S↑
FeS(固)+ H2SO4(稀)
FeSO4 + H 2S↑
(1)下面所给的仪器依次是带孔橡胶塞、分液漏斗、铁圈、导管和圆底烧瓶,请利用这些仪器,在右边的方框中组装出制取H 2S气体的发生装置(画示意草图)。

(2)收集H 2S气体可采用 法。
(3)实验过程中,使用分液漏斗滴加稀硫酸的操作是:
。
(4)将硫化氢气体通入硫酸铜溶液,观察到的现象
是: 。
(5)从保护环境减少污染考虑,实验需要对尾气进行吸收处理,根据硫化氢的性质,可用 溶液作为尾气吸收剂,反应的化学方程式为: 。
29.分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
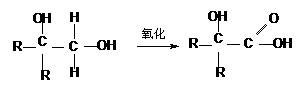
为了合成该物,某实验室的科技人员设计了下列合成路线:
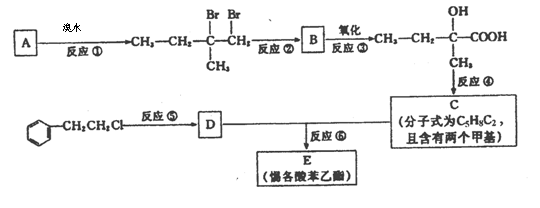
试回答下列问题:
(1)试写出:A的结构简式 ;B的结构简式 。
(2)反应②中另加的试剂是 ;反应④的一般条件是
(3)试写出反应生成E的化学方程式:
(4)上述合成路线中属于取代反应的是 (填编号)。
28.煤粉在隔绝空气中加强热,除主要得到焦炭外,还能得到下表所列的物质:
|
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
名称 |
甲烷 |
一氧化碳 |
乙烯 |
苯 |
甲苯 |
苯酚 |
氨水 |
(1)表中所列物质不属于有机物的是(填序号): 。
(2)能使溴水褪色的是(填序号): 。
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号) ,该物质发生加聚反应的化学方程式为: 。
(4)能使氯化铁溶液变为紫色的是(填序号): 。
(5)甲苯的一氯取代产物的有 种。
27. 将2
mol SO2和1 mol O2混合置于体积可变
将2
mol SO2和1 mol O2混合置于体积可变
的密闭容器中,在T1温度下发生如下反应:
2SO2(g)+O2(g) 2SO3(g) +Q(Q>0)
2SO3(g) +Q(Q>0)
当反应进行到时间t0点时达到平衡状态,测得混
合气体的总物质的量为2.1 mol。试回答:
(1)该反应的平衡常数表达式: 。
(2)反应进行到t0时SO2的的体积分数 。
(3)若保持温度为不变,使用催化剂,在图中作出
从反应开始到t0点这段时间SO2物质的量变化曲线。
(4)当反应进行到t1时间时(t1 >t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t2 时间时(t2>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量 ______2.1 mol(填“<”、“>”或“=”)。
26.在一容积为2L且容积不变的密闭容器中加入适量碳粉和0.2molH2O。在800 °C条件下,经20s后达到如下化学平衡:C(s) +H2O(g)  CO(g) + H2(g) + Q。已知达到平衡(I)时,CO为0.12mol。试回答:
CO(g) + H2(g) + Q。已知达到平衡(I)时,CO为0.12mol。试回答:
(1)写出上述反应平衡常数的表达式: ;
(2)若用υ(H2O)表示该反应前20s内的平均速率,则υ(H2O)= ;
(3)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新的平衡(II),则平衡时H2的物质的量 (填“增大”、“减小”、“不变”)。理由是:
。
(4)若向上述平衡(I)的混合物中再充入a mol H2( a < 0.12 ),在相同条件下达到新的平衡(III),此时,CO的物质的量n的取值范围是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com