
题目列表(包括答案和解析)
6.中和滴定 ①准备过程:检查滴定管是否漏水;用水洗涤玻璃仪器;用少量标准液或待测液润洗装标准液的滴定管或装待测液的滴定管;装液体(在锥形瓶中放一定量待测液),排气泡、调零点并记录初始读数。当然也可以用待测液滴定标准液。 ②滴定过程: 姿态:左手控制活塞或小球,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化。 滴速:逐滴滴入,当接近终点时,应一滴一摇。 终点:最后一滴刚好使指示剂颜色发生明显改变时即为滴定终点。记录读数(半分钟不褪色) ③数据处理及误差分析(略)
5.物质的分离与提纯中的基本操作
|
操作名称 |
适用范围和实例 |
装 置 |
操作要点 |
|
过滤(沉淀洗涤) |
固体(不溶)一液体分离
例:除去粗盐中的泥沙 |
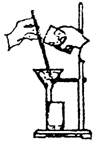 |
(1)对折法折叠滤纸后紧贴漏斗壁,用水打湿不出气泡为止,滤纸边缘低于漏斗;过滤时加入漏斗的溶液面低于滤纸边缘,即“一贴两低三靠”。
(2)过滤时:烧杯嘴与玻璃棒接触;玻璃棒与三层滤纸处相接触;漏斗嘴紧靠玻璃烧杯壁。
(3)加水,水面高于沉淀,浸洗三次,达到净化沉淀。 |
|
蒸发结晶(重结晶) |
固体一液体分离,例:食盐溶液的蒸发结晶。
利用物质在同一溶剂中溶解度不同,进行固体一固体(均溶)分离。例:KNO3,NaCl的结晶分离。 |
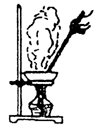 |
(1)蒸发皿可直接受热。固定在铁架台的铁环上。
(2)加热时用玻璃棒不断地搅动防止热液溅出,发现溶液出现较多固体快干时撤火。利用余热将溶液蒸干。 |
|
蒸馏分馏 |
分离沸点不同的液体混和物
例:从石油中分馏出各馏分。从乙醇、乙酸、浓H2SO4混和液中蒸馏出乙酸乙酯。 |
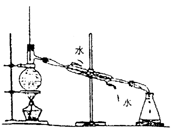 |
(1)蒸馏烧瓶加热要垫石棉网,温度计水银球放在支管口各向下的位置。
(2)冷凝管横放时头高尾低保证冷凝液自然下流,冷却水与被冷凝蒸气流向相反。
(3)烧瓶中放入多孔瓷片以防爆沸。 |
|
萃取分液 |
将两种互溶的液体分开。将两种互不相溶的液体分开。
例:用CCl4将碘从碘水中萃取出来后,再分液分离 |
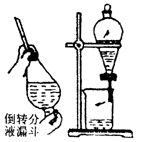 |
(1)将溶液注入分液漏斗,溶液总量不超过其容积3/4,如图所示,两手握住分液漏斗、倒转分液漏斗并反复、用力振荡。
(2)把分液漏斗放在铁架台的铁圈中静置、分层。
(3)打开旋塞,使下层液体流出。 |
|
洗气 |
气一气分离(杂质气体与试剂反应)例:用饱和食盐水除去Cl2气中的HCl杂质,用Br2水除去CH4中的C2H2。 |
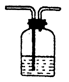 |
混和气体通入洗气瓶
注意气体流向,长进短出。 |
|
渗析 |
胶粒与溶液中的溶质分离。例:用渗析的方法除去淀粉胶体中的NaCl。 |
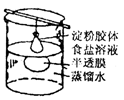 |
将要提纯的胶体装入半透膜中,将半透膜袋系好,浸入蒸馏水中,渗析的时间要充分。 |
|
加热 |
杂质发生反应。例:Na2CO3中含有NaHCO3杂质。MnO2中混有炭粉杂质可用加热法除去。 |
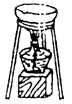 |
用玻璃棒搅拌,使受热均匀 |
|
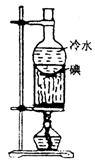
升华 |
分离易升华的物质。例:碘、萘的提纯 |
 |
1 |
|
盐析 |
胶体从混和物中分离出来。例:硬脂酸钠溶液中加入食盐细粒;鸡蛋白溶液中加入饱和(NH4)2SO4溶液 |
1 |
1 |
|
离子交换 |
将溶液中的离子与液体分离。例:软化硬化 |
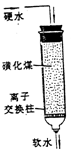 |
1 |
4.溶液的配制 ①配制一定质量分数溶液的操作步骤: 计算、称量(对固体溶质)或量取(对液体物质)、溶解。 ②配制一定物质的量浓度溶液的操作步骤: 计算(溶质质量或体积)、称量或量取、溶解、降至室温、转入容量瓶中、洗涤(2-3次,用玻璃棒再次移入)、定容(加水到刻度线下2-3厘米处,改用胶头滴管加至凹液面最低点与刻度相切)、摇匀、装瓶(注明名称、浓度) 说明:在溶解时放出大量的热的物质,例如浓硫酸的稀释、浓硫酸和浓硝酸混合,都应把密度较大的浓硫酸沿器壁慢慢注入另一种液体中,并用玻璃棒不断搅拌。
3.常见指示剂(或试纸)的使用 ①常见的酸碱指示剂有石蕊、酚酞和甲基橙,应熟记它们的变色范围。使用时将指示剂取几滴滴加到试管中的待测液中,观察颜色变化。 ②常见试纸有石蕊试纸(红色或蓝色)、PH试纸(黄色)、淀粉碘化钾试纸(白色)以及酸铜铅试纸等;用试纸测气体的酸碱性时,应用镊子夹着试纸,润湿后放在容器的气体出口处,观察颜色的变化。使用pH试纸时应把试纸放在玻璃片或表面皿上,用玻璃蘸取待测涂涂在试纸上,及时用比色卡比色,读出待测液的pH值,注意pH试纸不能用水润湿。要注意切不可把试纸投入到溶液中。 Cl2、Br2、NO2、O2等氧化性较强的气体,均可使润湿的淀粉碘化钾试纸变蓝。
2.玻璃仪器的洗涤 (1)水洗法:在试管中注入少量水,用合适毛刷蘸洗涤剂刷洗,再用水冲洗,最后用蒸馏水清洗,洗涤干净的标志是:附着在玻璃仪器内壁上的水既不聚成水滴,也不成股流下。 (2)药剂洗涤法: ①附有不溶于水的碱、碱性氧化物、碳酸盐。可选用稀盐酸清洗,必要时可稍加热 ②附有油脂,可选用热碱液(Na2CO3)清洗 ③附有硫磺,可选用CS2或NaOH溶液洗涤 ④附有碘、苯酚、酚醛树脂的试管用酒精洗涤 ⑤作“银镜”、“铜镜”实验后的试管,用稀硝酸洗 ⑥用高锰酸钾制氧气后的试管附有二氧化锰,可用浓盐酸并稍加热后再洗涤 ⑦盛乙酸乙酯的试管用乙醇或NaOH溶液洗涤。
(七)连接的仪器及用品 单孔器、双孔塞、无孔塞、玻璃导管、橡皮管。 另外还有一些仪器,玻璃棒、试管刷、研钵、接收器
(六)夹持仪器 铁架台、铁夹、试管夹、滴定管夹、坩埚钳、三角架、泥三角、镊子、石棉网等。
(五)其它仪器
|
仪器图形与名称 |
主要用途 |
使用方法及注意事项 |
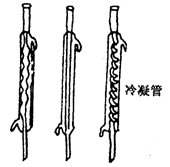 |
用于蒸馏分馏,冷凝易液化的气体 |
组装时管头高,和尾低,蒸气与冷却水逆向流动 |
 |
用作热源,火焰温度为500℃-600℃ |
所装酒精量不能超过其容积的2/3,但也不能少于1/4。加热时要用外焰。熄灭时要用盖盖灭,不能吹灭 |
 |
用作热源,火焰温度可达1000℃左右 |
需要强热的实验用此加热。如煤的干馏,炭还原氧化铜 |
 |
可用作蒸发皿或烧杯的盖子,可观察到里面的情况 |
不能加热 |
(四)干燥仪器
|
仪器图形与名称 |
主要用途 |
使用方法及注意事项 |
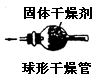 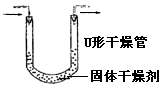 |
内装固体干燥剂或吸收剂,用于干燥或吸收某些气体 |
要注意防止干燥剂液化和是否失效。气流方向大口进小口出。 |
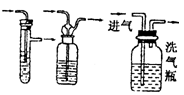 |
除去气体中的杂质 |
注意气流方向应该长管进气,短管出气 |
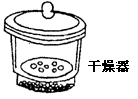 |
用于存放干燥的物质或使滴湿的物质干燥 |
很热的物质应稍冷后放入 |
(三)用作过滤、分离、注入容液仪器
|
仪器图形与名称 |
主要用途 |
使用方法及注意事项 |
 |
用作过滤或向小口容器中注入液体 |
过滤时应“一贴二低三靠” |
 |
用于装配反应器,便于注入反应液 |
应将长管末端插入液面下,防止气体逸出 |
 |
分离密度不同且互不相溶的液体;作反应器的随时加液装置 |
分液时,下层液体从下口放出,上层液体从上口倒出;不宜盛碱性液体 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com