
题目列表(包括答案和解析)
1、Ag++Cl-=AgCl↓;
4、D+E:产生白色沉淀和刺激性气味气体,沉淀不溶于稀硝酸。
试根据上述实验现象推断A、B、C、D、E的化学式,写出各步反应的离子方程式。
[解析]本题有一定难度,若阴、阳离子逐个组合、验证,最终也能得出结论,但绝不可取,必须全面分析,兵分六路率先突破。实验1、4都生成不溶于稀硝酸的白色沉淀,这两种沉淀不外乎是AgCl和BaSO4,D与E反应还生成刺激性气味的气体,显然是氨气,若沉淀是AgCl,则可溶性银盐只能是AgNO3,那么另一种就是NH4Cl,但AgNO3与NH4Cl反应不可能有氨气逸出,因此,实验1、4生成的沉淀分别只能是AgCl和BaSO4。
进一步推出,A、B中须有一种是AgNO3,另一种是氯化物;D、E中必有一种是(NH4)2SO4,根据阴离子组合,另一种只能是Ba(OH)2,且D不可能是(NH4)2SO4,因为找不到另一种金属离子(Ag+离子已排除)与SO42-离子结合生成不溶于稀硝酸的白色沉淀。因此,D只能是Ba(OH)2,E是(NH4)2SO4。余下的推断就不难进行了。
故本题的正确答案是:A是AgNO3,B是AlCl3,C是Na2CO3,D是Ba(OH)2,E是(NH4)2SO4。上述各步反应的离子方程式为:
3、C+D:产生白色沉淀,沉淀可溶于稀硝酸。
2、B+C:产生白色沉淀和无色无味气体。
[例1] A、B、C、D、E五种主族元素,位于周期表的前四周期,且原子序数依次递增,A、C两元素的电子层数相同,A、E两元素的最外层和次外层电子数相同,A和C形成化合AC,D和E形成化合物ED2,B元素的单质能从酸中置换出其1.5mol氢气。
(1)写出这五种元素的名称和符号;
(2)写出AC和ED2的电子式;
(3)写出这五种元素最高氧化物的水化物的分子式,分析其酸性变化情况;
(4)写出能形成气态氢化物的分子式,并比较其稳定性及水溶液导电的情况;
(5)B和D形成的白色固体,在1800C时升华,能溶于有机溶剂,试判断它是什么晶体?从蒸气密度测定表明,它具有双分子缔合结构,说明在两个单分子间通过什么键结合?试写出这种双分子的结构式。
[解析] 据题意,A、C同周期(因为相同的电子层数),A、E同主族(次外层和最外层电子数相同)。
据A+C→AC,有两种可能:A为ⅠA,C为ⅦA,或A为ⅡA族,C为ⅥA族;据D+E→ED2,可推测E为ⅡA族或ⅣA。综合以上情况,A、E应为ⅡA族元素,可推知C为ⅥA族,D为ⅦA族;因为A、B、C原子序数依次递增,所以B在A、C中间,且B元素在与酸反应中呈+3价,则B一定与A、C同周期,为ⅢA族元素。
又因为A、E次外层和最外层电子数相同,所以A、E不可能是2、3周期,而只可能是3、4周期。由此可得出A是镁,E是钙,并可推出B是铝,C是硫,D是氯。元素一经推出,其他问题便可迎刃而解。
所以本题的正确答案是:
(1)A是镁,Mg;B是铝,Al;C是硫,S;D是氯,Cl;E是钙,Ca。
(2)AC: 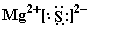 、ED2:
、ED2: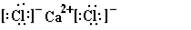
(3)
(4)H2S、HCl;稳定性:HCl>H2S;水溶液的导电性HCl溶液比H2S溶液强。
(5)B与D形成AlCl3,它是分子晶体。由于AlCl3分子中Al原子有空轨道,Cl原子有孤对电子,因此两个AlCl3分子可通过配位键形成双分子缔合结构。其结构式为:
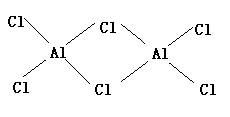
[例2]今有A、B、C、D、E五种溶液,溶质所电离出来的阴、阳离子分别是以下两组离子中的各一种,每种离子都不重复。
阳离子是:Na+、Al3+、Ba2+、Ag+、NH4+;阴离子是:Cl-、OH-、CO32-、NO3-、
SO42-。取溶液进行如下实验:
1、A+B:产生白色沉淀,沉淀不溶于稀硝酸。
找到解题的突破口,便是解题成功的一半。可从下列途径去找突破口。
(1)从物质的组成结构方面寻找
例如,具有正四面体结构的物质可能为甲烷或白磷或铵根离子;不含金属元素的离子化合物为铵盐等。
(2)从实验现象寻找
例如,向一溶液中滴入碱液,先产生白色沉淀,进而变成灰绿色,最后变成红褐色沉淀,则该溶液中一定含Fe2+;遇空气迅速由无色变为红棕色的气体必为NO,等等。
(3)从反应类型寻找
例如,同一元素的气态氢化物和气态氧化物反应生成该元素的单质和水,则该元素可能为S或N;能“三合一”的反应:NH3、H2O、CO2或氢氧化亚铁、水、氧气或NO2、O2、H2O;对不常见的反应,亦必须加以注意。
(4)从典型性质寻找
例如,密度最小的气体为H2;地壳中含量最多的元素为O,最多的金属元素为Al;溶解SiO2的酸为HF;遇苯酚生成紫色溶液的离子为Fe3+,等等。
(5)从反应条件控制
如必须控制170oC的反应比是制取乙烯的反应;必须在沸水浴中用浓盐酸作催化剂的反应必为制酚醛树脂的反应等。
(6)从数据去寻找
根据计算或题给信息,可获得某些数据,这些数据也可使我们找到突破口。如物质的熔点较低,说明为分子晶体;反之,亦可能为原子晶体。
请记好下列常用的知识规律,对解推断题会有较大帮助。
(1) 具有特征性质的物质归类
① 同一元素的气态氢化物与气态氧化物反应,生成该元素的单质与水,元素可能是硫或氮。
② 同一元素的气态氢化物与与最高价氧化物对应的水化物化合生成盐的元素一定是氮。
③ 两溶液反应生成沉淀和气体,这两种溶液的溶质分别为:a.氢氧化钡与硫酸铵。b.可溶性铝盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐。C.可溶性铁盐与可溶性碳酸盐或碳酸氢盐。d.硫代硫酸盐与强酸。
④ 既能与酸反应,又能与碱反应物质可能是Al、Al2O3、Al(OH)3、、氨基酸、弱酸的铵盐、弱酸的酸式盐等。
⑤ 既能与强酸反应放出气体又能与强碱反应放出气体,常见的物质有:Al、弱酸的铵盐[(NH4)2CO3、NH4HCO3、(NH4)2SO3、NH4HSO3、(NH4)2S、NH4HS等。
⑥ 在水中分解生成气体和难溶物或微溶物的物质可能是Al2S3、Mg3N2、CaC2等。
⑦ 与水接触放出气体的常见物质有:Li、Na、K、Na2O2、F2等。
⑧ A物质加到B物质中,先生成沉淀,后沉淀又溶解,A和B可能分别是CO2和Ca(OH)2、NaOH与铝盐、NH3与AgNO3溶液、HCl与NaAlO2、稀盐酸与Fe(OH)3胶体等。
⑨ 使溴水褪色的物质有:硫化氢、二氧化硫、不饱和烃类、活泼金属碱类等。
(2) 特征的实验现象
① H2在Cl2中燃烧呈苍白色火焰。在氯掘中燃烧生成魄烟雾的是磷。钠元素焰色反应为黄色,钾元素焰色反应为紫色。在空气中迅速由无色变为红棕色的气体是NO等。
② 遇酚酞变红的气体必为氨气。
③ 向一溶液中加入碱液,产生白色沉淀,进而变成灰绿色,最后变成红棕色,该溶液中必含有Fe2+。遇SCN-显红色或遇OH-生成红褐色沉淀或遇苯酚显紫色的离子是Fe3+。
④ 遇BaCl2生成生成不溶于稀硝酸的白色沉淀的溶液可能溶有SO42-或Ag+。遇HCl生成沉淀的溶液中可能含有Ag+、Si2O32-、S2O32-。
⑤ 具有臭鸡蛋气味的气体是H2S,与H2S反应生成淡黄色沉淀的气体可能是Cl2、O2、SO2、NO2等.
⑥ 电解电解质溶液时阳极气态产物一般是氯气和氧气,阴极气态产物是氢气。
⑦ 使品红褪色的气体可能是Cl2或SO2,物质可能是次氯酸钠、次氯酸钙、氯水、过氧化钠等。
(3) 特殊的转化关系
① 金属→碱性氧化物→碱→盐;
非金属→酸性氧化物→酸→盐。
② 交叉型转化关系
③ 三角形转化关系
Fe、Fe2+、Fe3+;S、H2S、S2-;Al、Al3+、AlO2-;烯、醇、卤代烃。
3.AC 4。AC 5、AD
2.
1、分析:本题要求针对混合物性状不同,选择适宜的分离或提纯的方法:
(1)属液、固分离,适合用过滤法。
(2)除去胶体中的分子或离子杂质,适合用渗析法。
(3)采用蒸馏的方法可以将乙醇提纯。
(4)加热碳酸钙会分解转化成氧化钙。
(5)利用碘易升华的性质,采用升华法将其与NaI分离。
答案:1、C 2、F 3、A 4、H 5、E
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com