
题目列表(包括答案和解析)
18.(Ⅰ)A、B均是盐,由A溶液和B溶液出发,可发生下图所示的一系列变化(各步所加试剂均足量)
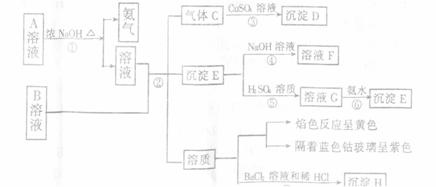
根据实验,回答有关问题:
(1)写出反应④和⑥的离子方程式
 (2)写出A和B的化学式A__________,B______________。
(2)写出A和B的化学式A__________,B______________。
(Ⅱ)向100mL 3mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入
1mol·L-1Ba(OH)2溶液。
(1)写出当刚好出现沉淀物质的量总量的最大值时的离子方程式(用一个式子表示):____________。
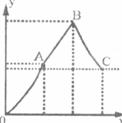
(2)随着Ba(OH)2溶液体积的变化,沉淀总物质的量的变化如右图所示(Y代表沉淀总物质的量/mol;X代表Ba(OH)2溶液体积/mL)。写出B点和C点所对应的Ba(OH)2溶液的体积:B_____________,C______________。
17.已知:(A)Cu2+,Fe2+在pH值为4-5的条件中不水解而Fe3+却几乎全部水解
(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50毫升纯净的盐酸,加入一定量的粗CuO,加热搅拌,充分反应后过滤,经测定溶液的pH值是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH值为4,过滤。
④把③所得滤液浓缩。
填空:
(I)②中发生反应的离子方程式是__________________________________。
(Ⅱ)③中过滤后滤渣的成分是____________________________________。
(Ⅲ)④浓缩过程中的溶液颜色变化是:________________________________。
(Ⅳ)③中pH值升高的原因是:______________________________________。
16.(1)现有①硫酸溶液、②醋酸溶液、③盐酸三种溶液
①当pH值相等时,三种酸的物质的量浓度由大到小的顺序是(用①②③表示)__________。
②当物质的量浓度相等时,三种酸溶液的pH值由小到大的顺序是(用①②③表示)_________。
③取pH值都等于3的①②③三种溶液各100mL,分别向其中加入10mLpH=12的Ba(OH)2,溶液,反应后pH值最小的是___________。
简答理由____________________________________________________。
(2)①在6份0.01 moL/L氨水中分别加入下列各物质:A.浓氨水,B.纯水,C.少量K2SO3固体,D.少量浓硫酸,E.少量NaOH固体,F.少量Al2(SO4)3,固体。
(a)能使[OH-]减小,使[NH ]增大的是____________;(b)能使[OH-]增大,使[NH
]增大的是____________;(b)能使[OH-]增大,使[NH ]减小的是________;(c)能使[0H-]和[NH
]减小的是________;(c)能使[0H-]和[NH ]都增大的是_________;(d)能使[OH-]和[NH
]都增大的是_________;(d)能使[OH-]和[NH ]都减小的 是______________。
]都减小的 是______________。
②25℃时用Pt电极电解500mL amol/L CuSO4溶液,试回答下列有关问题:
(a)写出两极的电极反应式:阳极____________,阴极__________。
(b)当电解到[Cu2+]为0.5a mol/L时,停止电解,若要使溶液恢复到与电解前相同的状态,可向溶液中加入适量的( )
(A)CuSO4粉末 (B)CuSO4·5H2O (C)CuO粉末 (D)Cu(OH)2
15.不溶于水的氧化亚铜(Cu2O),可溶于含有硫酸的Fe2(SO4)3,水溶液中,其化学方程式为Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O。此时生成的FeSO4可用酸性KMnO4溶液(硫酸酸化)滴定,其化学方程式为:
10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O
用这种方法可以测定氧化亚铜的含量。由计算可知,每毫升0.1mol/L KMnO4溶液相当于________mg Cu2O。怎样证明上述滴定操作刚好达到滴定终点。
14.已知稀盐酸的物质的量浓度为amol/L,稀NaOH溶液浓度bmoL/L,当两种溶液等体积混合后,所得溶液的pH=2(混合液的体积视为原溶液体积的加合),则a和b的关系为( )
(A)a=b/2 (B)b=a/2 (C)a=b+0.02 (D)a=b+0.01
13.将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积时m倍和n倍后,两溶液的pH值仍然相同,则m和n的关系是( )
(A)m<n (B)m>n (C)m=n (D)无法确定
12.将一定量盐酸和氨水混合后,溶液pH=7则原来的两溶液中氨和一水合氨与HCl的物质的量(分别用n1、n2表示)之间的关系为( )
(A)n1<n2 (B)n1=n2 (C)n1>n2 (D)以上都可能
11.25℃时,等体积硫酸和氢氧化钠溶液混合后,若溶液呈碱性,则混合前硫酸的pH值和氢氧化钠溶液的pH值之间应满足的关系是( )
(A)pH +pHNaOH>14 (B)pH
+pHNaOH>14 (B)pH +pHNaOH<14
+pHNaOH<14
(C)pH +pHNaOH=14 (D)pH
+pHNaOH=14 (D)pH +pHNaOH=13
+pHNaOH=13
10.已知0.1 mol/LNaHCO3溶液的pH为8.4,0.1 moL/LNa2CO3溶液pH是11.4,则由NaHCO3水解产生的[OH-]是由Na2CO3水解产生的[OH-]的( )
(A)3倍 (B)1/3倍 (C)103倍 (D)10-3倍
9.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的[OH-]分别为Amol/L与Bmol/L.则A和B的关系为( )
(A)A>B (B)A=10-4B (C)B=10-4A (D)A=B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com