
题目列表(包括答案和解析)
8. 翰林汇下列可逆反应达平衡状态后,降温可以使混和气体平均分子量减小的是
A.H2(气)+Br2(气) 2HBr(气)+Q
2HBr(气)+Q
B.N2(气)+3H2(气) 2NH3(气)+Q
2NH3(气)+Q
C.2SO3(气) 2SO2(气)+O2(气)-Q
2SO2(气)+O2(气)-Q
 D.4NH3(气)+5O2(气)
D.4NH3(气)+5O2(气) 4NO(气)+6H2O(气)+Q翰林汇
4NO(气)+6H2O(气)+Q翰林汇
7.
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(气)  H2(气)+I2(气)-Q,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(气)+I2(气)-Q,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
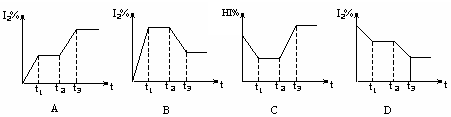
6.
一定温度时于密封容器中发生反应:mA(g)+nB(g)  pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的
pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的
A.平衡向正反应方向移动 B.C气体的质量分数增大
C.气体A的转化率降低 D.m+n>p
5.
将2 mol SO2和2 mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2
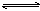 2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
A.2 mol SO2+1mol O2 B.4 mol SO2+1mol O2
C.2 mol SO2+1mol O2 +2 mol SO3 D.3 mol SO2+1 mol SO3
4. 从下列事实,不能用勒沙特列原理解释的是
A.溴水中有下列平衡Br2+H2O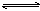 HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)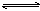 H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2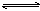 CO2+NO+Q,升高温度可使平衡向逆反应方向移动
CO2+NO+Q,升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
3.
在3NO2+H2O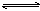 2HNO3+NO+Q反应达到平衡后,改变下列条件,可使HNO3浓度增大的是
2HNO3+NO+Q反应达到平衡后,改变下列条件,可使HNO3浓度增大的是
A.升温 B.减压 C.加水 D.通入O2
2. 一定温度下,在固定容积的密闭容器中,可逆反应:
mA(气)+nB(气) 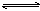 pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率VA:VB:VC:VD=m:n:p:q,其中,能说明反应已达到平衡的是
pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率VA:VB:VC:VD=m:n:p:q,其中,能说明反应已达到平衡的是
A.只有③④ B.②③④ C.①⑵⑶④ D.①②③④⑤
1.
反应4NH3+5O2 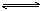 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
A.V(O2)=0.01mol·L-1 ·s-1 B.V(NO)=0.008mol L-1 ·s-1
C.V(H2O)=0.015mol L-1 ·s-1 D.V(NH3)=0.002mol L-1 ·s-1
20.取等物质的量浓度的NaOH溶液两份,每份为50mL。向其中各通入一定量的CO2,随后分别各取溶液10mL,将其稀释成100mL;并分别向稀释后的溶液中逐滴加入0.1mol·L-1的HCl溶液,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如下图所示:(设分别为A、B两种情况)。
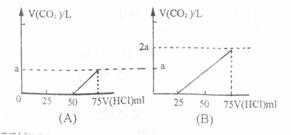
回答下列问题:
(1)在(A)情况下,溶质为(写化学式)__________,其物质的量之比为__________,在标准状况下CO2气体的体积为____________。
(2)在(B)情况下,溶质为(写化学式)________________,其物质的量之比为______,在标准状况下CO2气体的体积为____________。
(3)原NaOH溶液的物质的量浓度为____________。
19.将mg铁粉在500mL pH=1的盐酸中完全溶解,向溶液中通入适量的氯气,恰好完全反应后,再加入0.02mol/L的NiIx溶液500mL时,刚好使I-转变为I2析出,此时溶液的pH=2。已知反应前后Nix+的化合价没有变化,反应过程中溶液体积的变化可以忽略。试通过计算求(1)m值。(2)x值。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com