
题目列表(包括答案和解析)
1、同温同压下,aLXm气体和bLYn气体化合,生成cL的化合物z,则z的化学式为( )
A、XaYb
B、XnYm
C、XamYbn
D、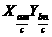
2、热化学方程式
注意:(1)热化学方程式中的计算系数仅表示物质的量,与普通化学方程式不同(计
量系数还可表示微粒数或体积),因此可出现分数或小数。
(2)必须标明各种物质的聚集状态,否则热方程式无任何意义。如H2和O2反应生成
水,水的状态不标明,生成气态水和液态水放出量是不同的。
(3)热方程式中的热量值必须与反应物的物质的量一致。如:铝在纯氧中燃烧,每生成1gAl2O3(固)放出QkJ热量,写出其热化学方程式。
4Al(固)+3O2(气)=2Al2O3(固)+204QkJ。在这个化学方程式中是否将热量写成QkJ?不能,因为该反应中生成了204g Al2O3,即放出204QkJ热量。
[能力训练]
1、概念--化学反应过程中放出或吸收的热量称为反应热
思考:(1)化学反应是否一定伴随热量的变化?
(2)凡是吸热或放热过程中热量的变化均称为反应热?
(答(1)不对,化学反应一定伴随着能量的变化,不一定是热量的变化,通常化学反
应中伴随着热量的变化。(2)不对,必须是化学变化过程中热量的变化。例如:NaOH(固)、浓H2SO4溶于水放出大量的热,液氨气化吸收大量的热均不能称为反应热)
3、物质的量浓度配制
(1)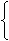 达到两个规定
规定配制溶液里所含溶质的量
达到两个规定
规定配制溶液里所含溶质的量
规定室温时溶液的体积。
如配制500mL、1mol·L-、NaOH溶液,必须取20gNaOH,500mL容量瓶,而不能取10gNaOH配成250mL溶液。
(2)操作步骤
在配制溶液之前首先检查容量瓶是否漏水
①计算(所需溶质的质量或体积) ②称量或量取
③溶解(适量水) ④转移 ⑤洗涤2-3次(一般每次用水10-15mL)
⑥振荡 ⑦定容摇匀、溶液配制以后要立即倒入试剂瓶中,容量瓶不允许久置溶液(凡有精确刻度的仪器均不能久置溶液,均不能作为反应容器)
(3)误差分析
思考:下列操作会引起配制的溶液浓度偏大还是偏小或不变?
①配制溶液时容量瓶中有少量水
②转移溶液时溅出少量溶液至容量瓶外
③未用蒸馏水洗涤烧杯2-3次
④定容时视线高于容量瓶刻度浅(即俯视)
(答①不变 ②③均变小 ④偏高)
2、溶液中溶质微粒数目
(1)非电解质:微粒数=C·V·N0
(2)强电解质(完全电离,不考虑水解)设化学式AmBn,则其微粒数=C·V·(n+m)·N0
(3)弱电解质:分子、离子共存。VL、Cmol·L-1、电离度为α的CH3COOH,所含
微粒数目为C·V(1+α)
(4)考虑水解
例1、温度均为0.1mol·L-1的氨水和盐酸等体积混合后,溶液中各离子浓度大小关系?
[Cl-]>[NH4+]>[H+]>[OH-]
思考:①在含有下列离子的溶液中,加入少量H2SO4,使其数目略有增加的是( )
A、SO32- B、Fe3+ C、HCO3- D、Na+
(答:B,因为Fe3+要水解,加酸、抑制其水解)
②10mL0.1mol·L-1AlCl3溶液和0.1mol·L-140mLKOH溶液混合后,各离子浓度由大
到小的顺序?
(答:[K+]>[Cl-]>[AlO2-]>[OH-]>[H+])
1、C=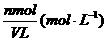
例1、判断下列说法是否正确?
(1)1L水溶解了22.4LHCl, C=1mol·L-1?(错,溶液体积不为1L,物质的量不一定是1mol)
(2)160g胆矾溶于水配成1L溶液C=1mol·L-1?(错,溶质物质的量小于1mol)
(3)74gCa (OH)2溶于水配成1L溶液C=1mol·L-1?(错,Ca (OH)2微溶)
例2、标况下,盛满HCl烧瓶与用排空气法收集的HCl(VHCl占75%)烧瓶例置于水
中,其物质的量浓度关系?(相等,均等于 )
)
思考:CH3COONa、NaClO溶液PH值相同,则这两溶液物质的量浓度关系?(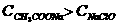 ,因为等物质的量浓度CH3COONa和NaClO溶液,NaClO水解程度大)
,因为等物质的量浓度CH3COONa和NaClO溶液,NaClO水解程度大)
4、阿佛加德罗定律--同温同压,相同体积的任何气体,都含有相同数目的分子即V1=V2,则n1=n2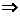 引伸:
引伸:
(1)同温同压任何气体体积比等于其物质的量比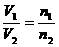
(2)同温同压任何气体密度比等于其摩尔质量(式量)之比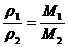
(3)同温同压等质量的任何气体,密度之比等于其物质的量(体积)的反比
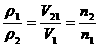
(4)同温同体积的任何气体,压强之比一定等于其物质的量之比
例1、标况下,mg气体A和ng气体B的分子数相等,下列说法不正确的是( )
A、同体积的气体A和气体B的质量比为m:n
B、25℃时,1kg气体A和1kg气体B的分子数比为m:n
C、同温同压时气体A和气体B的密度比为n:m
D、标况时,等质量的A和B气体的体积比为n:m
解析:由题设条件,可看作气体A的式量为m,气体B的式量为n(这是至为关键的)本题即为阿佛加德罗定律及引伸的运用,显然在运用时注意前提条件A中缺少同温同压条件,只有同温同压下,体积相同,则A、B物质的量相同。质量比才为m:n,而B中与温度压强没有关系,但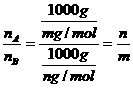 ,C中同温同压密度比等于其式量比,应为m:n,因此正确答案为A、B、C。
,C中同温同压密度比等于其式量比,应为m:n,因此正确答案为A、B、C。
例2:4mLO2和3mLNxHy(y>x)混合气体在120℃, 1.01×105Pa下点燃完全反应后恢复到原温度和压强时,测得反应后N2、O2、H2O(g)混合气体密度减小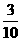 ,
,
(1)其反应的化学方程式为____________________________________
(2)推算NxHy的化学式,计算的根据是_________________________(用文字叙述)。
即(用含x、y的代数式表示)_________________。解此方程当_______________时合理,所以NxHy的化学式为____________。
解析:(1)由题意可知氧气过量,且产物为N2和H2O,则反应化学方程式为:
4 NxHy+yO2=2xN2+2yH2O
(2)计算x、y依据是什么?注意题目提供条件及隐含条件:同温同压,反应前后均为气体,且质量不变。显然依据是同温同压同质量任何气体,密度比等于其物质的量反比。计算方法用差量法:4 NxHy+yO2=2xN2+2yH2O△V
4 2x+2y-4-y
3
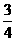 (2x+y-4)
(2x+y-4)
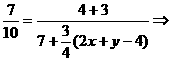 2x+y=8,即x=2, y=4合理,因此化学式为N2H4。
2x+y=8,即x=2, y=4合理,因此化学式为N2H4。
3、气体摩尔体积--在标准状况下(同温同压,只是在0℃,1.01×105Pa),1摩(等物质的量)的任何气体(单质、化合物、混合物等,只要是气体)所占的体积都约是22.4升。
(1)标况下1摩任何气体所占体积一定是22.4升
(2)非标准状况,1摩H2所占体积一定不可能是22.4L
(3)标况下,1mol水蒸气所占体积为22.4L
(4)标况下,1molSO3所占体积为22.4L
(5)标况下,1molNO2气体所占体积为22.4L
解析:(1)不对,抓住气体摩尔体积中的约是;(2)不对,非标准状况1mol气体也
可能为22.4L(如温度为273℃,压强为2.02×105Pa)
(3)(4)不对,在标况下H2O为液体,而SO3为固体。
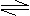 (5)不对,因为2NO2 N2O4+Q,标况下(温度低)NO2部分转化为N2O4,气体
(5)不对,因为2NO2 N2O4+Q,标况下(温度低)NO2部分转化为N2O4,气体
物质的量小于1mol。
2、等物质的量气体体积大小--主要决定于分子间的平均距离,因为通常情况下,分子间的平均距离是分子直径的10倍左右,而分子间的平均距离的大小由温度和压强决定,温度升高或压强减小,平均距离增大,反之减小。但只要是在同温同压下,任何气体分子间的平均距离相等。
1、等物质的量的液体、固体体积大小--主要决定于构成它们微粒的大小,而温度、
压强对其体积大小几乎没有影响。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com