
题目列表(包括答案和解析)
1、已知31g白磷变成红磷放出18.39kJ热量,下列两反应中:
4P(白、S)+5O2(g)=2P2O5(s),△H=Q1 kJ/mol
4P(红、S)+5O2(g)=2P2O5(s),△H=Q2 kJ/mol
则Q1和Q2的关系是:
A、Q1>Q2 B、Q1=Q2 C、Q1<Q D、无法确定
26.(5分) 将一小块质量为 w g的焦炭和n g O2同时放入一个装有压力表的密闭容器中,压力
所示为p0,当容器内充分发生反应后,恢复至原温度,压力表所示为p1 。如果pl是po的m倍
(m>1),则w应满足的关系式是________________ ____,m的最大值是 _______。
解:
25.(1x4+2+0.5+0.5+1+1+2=11分) 右图表示的反应关系中,部分产物被略去,X为l mol固体,A、B、C各为l rnol无色气体,B在常温下为液体,D、E、F为气体,G为液体。则:
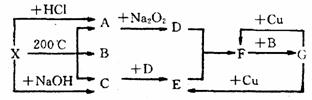
(1)写出化学式 X_______,C_________。(2) 写出化学方程式:
A→D_________ ____________________;F→G______ _______________________;
(3) 实验室需测定F的式量, 测出的数据常比理论值大。其原因是____________________
________________________________________ _(用方程式和必要的文字说明);
(4) 工业上合成C, 常用反应物______和______,合成后采用_____ ____方法
分离出______,能分离出该物质的原因是______________________ ____________。
24.(2+2+2+2=8分) 碳的稳定的氧化物除CO、CO2外,还有C3O2、C4O3、C5O2、C12O9等低氧
化物,其中C3O2是一种在常温下有恶臭的气体,其分子中的每个原子都满足最外层8电子结构。
假设在一定条件下 CH3COOH→CH2=C=O+H2O。①C3O2分子的电子式为________ ___;
②在上述碳的低氧化物中,若有分子空间构型与 C3O2相同的,最可能是_______;③不考虑反应条件,根据你现有的化学知识判断, O2、HCl能与 C3O2发生反应,请将能够反应的化学方
程式写在下面。__________ _____、________ __________________________。
23.(2+2+2+1+2=9分) (1)用过量的锌与浓 H2SO4反应,某同学认为除了生成SO2外,还有H2
产生。理由是________________________________________________________ ____;
(2) 用过量的铜片与0.2mol浓H2SO4共热足够长时间(只考虑铜与H2SO4反应,忽略其它副反
应)。甲认为产生的SO2等于0.1mol,理由是______________ ________________,
而乙同学认为产生的SO2小于0.1mol,理由是___________________ _______________;
你认为______同学正确。
(3) 工业制取CuSO4不是直接用铜和浓H2SO4反应,而是将Cu和少量Ag的混合物漫在稀H2SO4
中,并不断从容器下部吹入细小的空气泡,这样做的优点是________。
①不产生污染大气的SO2②提高H2SO4的利用率③节省能源④提高铜的利用率
22.(1+1+1+1+2+2=8分) A、B、C、D、E、F六种短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
|
|
甲 |
乙 |
丙 |
丁 |
戊 |
|
化合物中各元素的原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:C=1:1 |
E:F=1:3 |
B:F=1:4 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D与A同主族;E与F的原子序数之和为30;丙是离子化合物。
(l)F元素位于周期表中第__ _周期_ __族;E离子结构示意图是_ ___;
丙的电子式是___ __;(2)向甲的水溶液中加入MnO2,反应的化学方程式
为_________________________ _;(3)丁的水溶液与NaHCO3溶液混合会生成气体和沉淀,反应的离子方程式为___________________ ________________________。
21. (3+3=6分) 在有机溶剂里使 n mol PC15与 n mol NH4Cl定量地发生完全反应,释放
出 4n molHCl,同时得到一种白色晶体A。实验测得A的相对分子质量为348。
①生成A晶体的化学方程式:_________________ ________________________;
②分子结构测定实验表明:A分子中具有六元环结构,同种元素在A分子中所处的环境等同且
满足P五价、N三价、Cl一价。试推测A分子可能的结构(写结构式):_____ _。
20. (各1分,共11分) 致冷剂是一种易被压缩、液化的气体(致冷剂分子一般是①式量_ ____,
或②分子之间存在______键),液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致
冷目的。人们曾采用过乙醚、NH3,CH3Cl等作致冷剂,但它们不是有毒,就是易燃。于是科学
家根据元素性质的递变规律来开发新的致冷剂。据现有知识,某些元素化合物的易燃性、毒性
变化趋势如下:(1)氢化物的易燃性:第二周期 _______>_______>H2O>HF;
第三周期SiH4>PH3>________>________。
(2)化合物的毒性:PH3>NH3 H2S_____H2O;CS2____CO2 CCl4>CF4 (填>或<=),
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过
反复试验,一种新的致冷剂氟里昂CCl2F2终于诞生了,其它类似的还可以是________(举一例)
(4)然而,这种致冷剂造成了当今的某一环境问题是_______________ ___。但求助于周期表中元素及其化合物的_______变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(后一空格选填字母) ①毒性②沸点③易燃性④水溶性⑤颜色
A.①②③ B. ②④⑤ C.②③④
第Ⅱ卷(非选择题 共78分)
19. (2x4=8分) 某书本查得相对原子质量数据摘录如下:
(2x4=8分) 某书本查得相对原子质量数据摘录如下:
|
35Cl |
34.969 |
75.77% |
35Cl |
35 |
75.77% |
|
37Cl |
36.966 |
24.23% |
37Cl |
37 |
24.23% |
|
|
35.453 |
|
|
35.485 |
|
(1)34.969表示_____________ ____________;(2)35表示__________ _______________;
(3)35.453表示________________ __ __;(4)35.485表示____________ _________。
18.能说明BF3分子的4个原子在同一平面中的理由是:
A.B-F键为非极性键 B. 任意两个B-F键之间的键角为120”
C.三个B-F键的键能相同 D. 三个B-F键的键长相等
高三化学 第一轮复习 第二次检测试题 答题卷
班级 姓名 学号 成绩
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com