
题目列表(包括答案和解析)
9.下列离子方程式书写正确的是
A.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
B.氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+
C.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.碳酸氢镁溶液中加入过量石灰水:
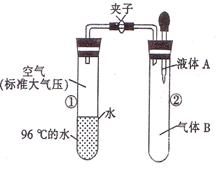
Mg2++2HCO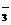 +Ca2++2OH-====CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-====CaCO3↓+2H2O+MgCO3↓
8.用NA表示阿伏加德罗常数,下列说法正确的是:
①18g D2O含有的电子数为10NA ②同温、同压下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ④在标准状况下,22.4LSO3的物质的量为1mol ⑤4℃时5.4mL的水所含的原子总数为0.9NA ⑥0.1molOH-含0.1NA个电子 ⑦1mol Na2O2与水完全反应时转移电子数为2NA
A.③⑤⑥⑦ B.③⑤ C.①②④⑦ D.③④⑤⑥
7.化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2, 类推2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。 下列各组类比中正确的是( )
A.由NH4Cl NH3↑+HCl↑,推测:NH4I
NH3↑+HCl↑,推测:NH4I NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O=NaHCO3+HClO
D.由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2SO3+2HNO3=2NaNO3+H2O+ SO2↑
6.在一定条件下,当64gSO2气体被氧化成SO3气体时,共放出热量98.3KJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是
A.SO2(g)+1/202(g) SO3(g);△H=-98.3KJ·mol-1
SO3(g);△H=-98.3KJ·mol-1
B.2SO2(g)+O2(g) SO3(l);△H=-196.6KJ·mol-1
SO3(l);△H=-196.6KJ·mol-1
C.SO2(g)+1/2O2(g) SO3(g);△H=-78.64KJ·mol-1
SO3(g);△H=-78.64KJ·mol-1
D.2SO2(g)+O2(g) SO3(g);△H=+196.6KJ·mol-1
SO3(g);△H=+196.6KJ·mol-1
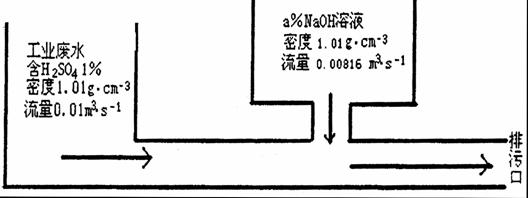
5.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合一定不可能是下列的
A、氢氧化钠溶液.二氧化碳 B、水.氨气
C、氢氧化钠溶液.一氧化氮 D、水.二氧化氮
4.某化工厂的工业废水中含H2SO4的质量分数为1%,采用边排放边中和的方法将它处理,使之基本呈中性,处理方法如图所示
若处理后的废水pH=7,则所用NaOH溶液中溶质的质量分数为
 A.0.5% B.1% C.2% D.4%
A.0.5% B.1% C.2% D.4%
3.在恒温恒容的密闭容器里发生可逆反应:2A(气)+B(气) 2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
A.2molA和lmolB B.1 molA和lmolB
C.1molA和2molB D.1molB和1 molC
2.不具有放射性的同位素称之为稳定同位素.稳定同位索分析法在近20年来植物生理学、生态学和境科学研究中获得广泛应用。如在陆地态系统研究中2H、13 C、15 N、18O、34S等常用作环境分析指示物下列说法正确的是
A.34S原子核内中子数为16 B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2 D.2H1的酸性比1H+的酸性更强
1.下列对生产、生活有关化学问题的分析正确的是
A.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质
B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
C.“百炼成钢”的化学含义是使用氧化剂提高生铁中碳的含量
D.液氯罐中的液氯泄漏时,可将其移入水塘中,并向水塘中加入生石灰
10.⑴ 稀盐酸(1分) KSCN溶液(1分)
2Fe2++Cl2=2Fe3++2Cl-(1分) Fe3++SCN-=[Fe(SCN)]2(1分)+
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色(1分)
Fe3+的3d轨道填充了5个电子,为半充满状态(1分)
⑶ 不合理(1分) 我的猜想是[Fe(SCN)]2+配离子中的SCN-被过量的氯水氧化(1分)。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com