
题目列表(包括答案和解析)
18.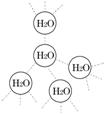 (5分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体--冰。
(5分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体--冰。
(1)氢键的形成使冰的密度比水 ,氢键有方向性和饱和性,故平均每个水分子最多形成 个氢键。
(2)实验测得冰中氢键的作用能为18.8 KJ/mol,而冰的熔化热为5.0KJ/mol,说明
。
17.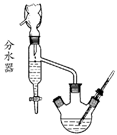 (10分)已知苯甲酸乙酯的沸点为213℃,水-乙醇-环己烷三元共沸物的共沸点为62.1℃(即在此温度下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出)。请回答就下述实验室制备苯甲酸乙酯提出的问题:
(10分)已知苯甲酸乙酯的沸点为213℃,水-乙醇-环己烷三元共沸物的共沸点为62.1℃(即在此温度下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出)。请回答就下述实验室制备苯甲酸乙酯提出的问题:
(1)①在圆底烧瓶中加入苯甲酸、浓硫酸、过量的乙醇、沸石。②再向烧瓶中加入环己烷,装上分水器和回流冷凝管。(②的目的是 );
(2)缓慢加热回流,至分水器下层液体不再增多,停止加热;放出分水器中液体(液体的三种主要成分是 );继续加热,使多余的 蒸至分水器中;至分水器中液体不再增加,停止加热;
(3)将圆底烧瓶中残液倒入盛有冷水的烧杯中,用 溶液中和至弱碱性;用 进行 操作,分出粗产品;水层用乙醚 ,醚层与粗产品合并;用纯水洗有机层2次,将醚层与水尽量分净,醚层从上口倒入一个干燥的锥形瓶;
(4)加入适量豆粒大小的无水氯化钙干燥剂,摇动锥形瓶,至醚层澄清透明;醚层过滤入一个干燥的圆底烧瓶;进行 ,先蒸出 ;后蒸出苯甲酸乙酯。
16.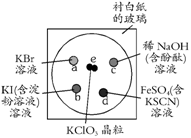 (10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述反应的现象,并写出相应的化学方程式。
e处:
a处:
b处:
c处:
d处:
15.某硝酸盐受热分解的产物为金属氧化物和NO2、O2。下列相关叙述正确的是( )
A.分解产生的气体能使余烬木条复燃,证明其中含有氧气
B.若分解的固体产物全为CuO,则产生的混合气体从理论上说可恰好完全溶解于水
C.若产生NO2和O2的物质的量之比为6∶1,则金属元素在分解过程中化合价降低
D.若3.76 g Cu(NO3)2无水晶体受热分解,得到1.52 g固体,则固体中有Cu2O 0.72g
14.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达成平衡:X(g)+Y(g)=2Z(g);△H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡比较,正确的是( )
|
|
改变的条件 |
新平衡与原平衡比较 |
|
A |
升高温度 |
X的体积分数变大 |
|
B |
增大压强 |
Z的浓度不变 |
|
C |
减小压强 |
Y的体积分数不变 |
|
D |
充入一定量Z |
X的体积分数变大 |
13.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81 g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀。由此可推断出X的化学式为( )
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3
D.K2SO4·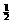 Cr2(SO4)3
Cr2(SO4)3
12.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
A.负极反应为:14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围PH升高
C.每消耗1 mol C2H6,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
11.甲苯加到汽油中可增加汽油的辛烷值。空气与甲苯蒸气的体积比约为以下何值时,甲苯可发生完全燃烧( )
A.9∶1 B.11∶1
C.26∶1 D.43∶1
10.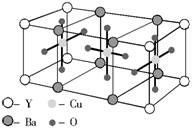 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是( )
A.1 mol该化合物中有1 mol Y
B.1 mol该化合物中有6 mol O
C.1 mol该化合物中有2 mol Ba
D.该化合物的化学式是YBa2Cu3O6
9.下列各组离子在溶液中能大量共存,当溶液呈强酸性时,有气体产生;而当溶液呈强碱性时,又能生成沉淀。该组离子可能是( )
A.Na+、Cu2+、NO3-、CO32- B.NH4+、K+、Cl-、HCO3-
C.Mg2+、NH4+、SO42-、Cl- D.Fe2+、Na+、SO42-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com