
题目列表(包括答案和解析)
21、 一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a
%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a %的是
( )
一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a
%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a %的是
( )
A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
20、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
19、下列各组离子一定能大量共存的是 ( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在C(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
18、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
A.2Na218O2 + 2H2O == 4Nal8OH + O2↑
B.2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑+ 8H2O
C.NH4Cl + 2H2O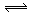 NH3·2H2O + HCl
NH3·2H2O + HCl
D.K37ClO3 + 6HCl == K37Cl + 3Cl2↑+ 3H2O
17、下列离子反应方程式正确的是 ( )
A.用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O ==2HCO3-+SO32-
B.二氧化硫气体通入到过量Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液
NH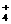 +H++2OH-
+H++2OH- NH3·H2O+H2O
D.KHS的水解:HS-+H2O
 H3O ++S2-
H3O ++S2-
16、对于某些离子的检验及结论一定正确的是 ( )
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有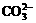
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有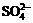
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
15、叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是 ( )
A.
HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(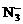 )>c(OH-)
)>c(OH-)
B. HN3与NH3作用生成的叠氮酸铵是共价化合物
C.
NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(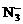 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.
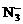 与CO2含相等电子数
与CO2含相等电子数
13、阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.标准状况下,a L甲烷和乙烷混合气体中的分子数约为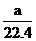 ×6.02×1023
×6.02×1023
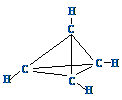
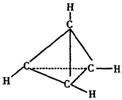 14、一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,
14、一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,
生成的卤代烃的种类共有 ( )
A.2 B.4
C.5 D.6
12、对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是 ( )
A、Br- B、SO42- C、H2SO3 D、NH4+
11、下列说法正确的是 ( )
A、难失去电子的原子,易形成阴离子
B、单质分子中不存在化学键,化合物的分子才存在化学键
C、含有金属元素的离子不一定是阳离子
D、由不同种原子所形成的纯净物一定是化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com