
题目列表(包括答案和解析)
5. 洗气瓶Y中所装的液体应是(不允许非水杂质混在气体中)( )
A. 浓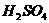 B.
B.
 溶液
溶液
C. 饱和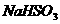 溶液 D.
溶液 D. 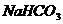 溶液
溶液
4. 制取某无色非金属氧化物气体时,烧瓶X内的药品应是( )
A. 铜和稀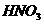 B.
铜和浓
B.
铜和浓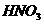
C. 碳酸钙与稀硫酸 D. 亚硫酸钠和浓盐酸
3. 某课外活动小组欲利用如图2装置和下列试剂制取少量氧气或氯化氢气体:
A. 浓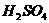 B.
浓盐酸 C.
食盐 D.
B.
浓盐酸 C.
食盐 D.
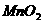 E.
E.
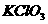
F. 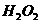 G.
G.  溶液
溶液
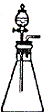
图2
试用各试剂序号回答:
(1)若要快速制备少量氧气,应选择( )。
(2)若要快速制备少量氯化氢,应选择( )。
如图3装置,请选择A~D序号填入4-6题的括号内。
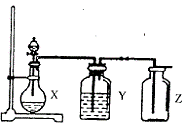
图3
2. 图1是实验室制备、干燥、收集某种气体的示意图,在不考虑是否加热的情况下,圆底烧瓶中的固体和分液漏斗中的液体可能是( )
A. 硫化亚铁和盐酸
B. 亚硫酸钠和浓硫酸
C. 锌和稀硫酸
D. 石灰石和硫酸
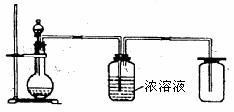
图1
1. 欲制备干燥的 ,所需要的试剂是( )
,所需要的试剂是( )
A. 固体氯化钠、浓硝酸、五氧化二磷
B. 固体氯化钠、浓硫酸、氨水
C. 固体氯化钠、浓硫酸、固体氢氧化钠
D. 固体氯化钠、浓硫酸、碱石灰
29. (16分)
(1) 4; ⅣB
(2) 将Fe3+还原为Fe2+; 析出(或分离、或得到)FeSO4·7H2O
(3) FeSO4·7H2O; 石灰(或碳酸钙、废碱)
(4) -80 kJ·mol-1 ; 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
28. (1) ⅠA (2) 物理变化 (3) NaCl;585 t
(4) NaOH+SO2=NaHSO3; NaHSO3+HCl=NaCl+H2O+SO2 (5) C、D
。
27. (1)①③④
(2)碳碳双键,羧基
(3)HO-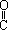 -CH=CH-
-CH=CH-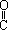 -OH; CH2=C(COOH)2
(4)HO-
-OH; CH2=C(COOH)2
(4)HO-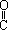 -CH=CH-
-CH=CH-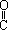 -OH+2CH3OH
-OH+2CH3OH
CH3O-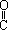 -CH=CH-
-CH=CH-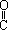 -OCH3+2H2O
(5)HO-
-OCH3+2H2O
(5)HO-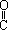 -CH2-
-CH2-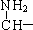
 -OH
-OH
29.(16分)
钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下: (05广东化学.22)
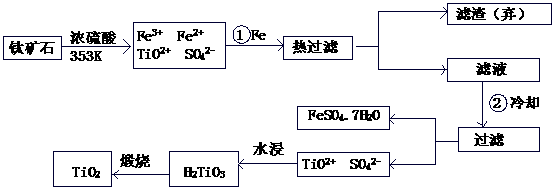
(1) Ti的原子序数为22,Ti位于元素周期表中第 周期,第 族。
(2) 步骤①加Fe的目的是 ;
步骤②冷却的目的是 。
(3) 上述制备TiO2的过程中,可以利用的副产物是 ;考虑成本和废物综合利用因素,废液中应加入 处理。
(4) 由金红石(TiO2)制取单质Ti,涉及到的步骤为:
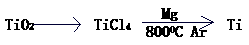
已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
反应TiCl4+2Mg=2MgCl+Ti 在Ar气氛中进行的理由是 。
DCDAAACC
26 (1)Al;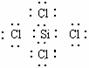
(2)Al3++3AlO2-+6H2O=4Al(OH)3↓ (3)光照; 过量Cl2
(4)Al4C3+12H2O=4Al(OH)3+3CH4↑
解析:可从H、G是正四面体结构的非极性分子,H与Cl2反应得G考虑,知H是CH4,G是CCl4。由B是金属,能与A、C这两种常见化工原料反应得到同一物质E,且所生成的另一物质D和F能反应生成一种高温能分解的物质,可知B应是Al。推出的物质应是:
A:HCl B:Al C:NaOH D:AlCl3 E:H2 F:NaAlO2 G:CCl4
H:CH4 I:Al(OH)3 J:Al2O2 K:Al4C3
26 (1)NH3; NH4Cl
(2)H2+Cl2 2HCl
2HCl
(3)2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2 (05MCE1.26)
2NH3↑+2H2O+CaCl2 (05MCE1.26)
28.(14分)海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。 (05广东大综合.35)
(1) 海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第 族。
(2) 目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(3) 工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O ® NaOH+H2+Cl2(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐 t。(可能需要的相对原子质量:Na 23 Cl 35.5
H 1 O 16)
(4) 近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
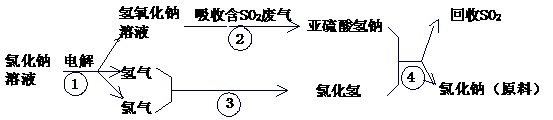
请写出②④的化学反应方程式: 、 。
(5) 上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有 。(填字母)
A. 皂化反应 B. 聚合反应 C. 与金属钠反应 D. 氧化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com