
题目列表(包括答案和解析)
27.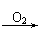
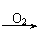 (8分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
(8分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
物质转化关系:R-CH2OH RCHO RCOOH
相对分子质量: M M-2 M+14
已知:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应,物质C的相对分子质量为104。A与其他物质之间的转化关系如下图所示:
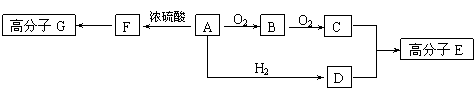
请回答下列问题:
⑴F中含有的官能团有 ;G的结构简式 。
⑵一定条件下B发生银镜反应的化学方程式 。
⑶由C、D在一定条件下反应还能生成环状化合物,其化学反应方程式为
。
⑷A的同分异构体很多,写出与A中所含官能团不同,但能与NaOH溶液反应的2种同分异构体的结构简式: 。
26、(13分)Fe是地壳中含量很丰富的元素,也是生物体所必须的元素。
(1) 我国南方某些地区的井水取出久置之后,井水由澄清变成少量红棕色絮状沉淀积于缸底,水面浮着一层“锈皮”。这层“锈皮”的主要成分是(写化学式) 。
(2) 家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是 (填字母代号);
A.4Fe(OH)2 + 2H2O + O2 == 4Fe(OH)3 B.2Fe + 2H2O + O2 == 2Fe(OH)2
C.2H2O + O2 + 4e- == 4OH- D.Fe – 3e- == Fe3+
(3) 某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3+ + SO32- + H2O == 2Fe2+ + SO42- + 2H+;二是发生双水解反应:2Fe3+ +3SO32- +6H2O == 2Fe(OH)3(胶体) + 3H2SO3。为了证明是哪一种反应,同学们设计并实施了下列实验,请填写下列空白:
①实验Ⅰ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变为血红色,反应的离子方程式为 。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式 。
②实验Ⅱ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ,产生的现象完全相同。由上述实验得出的结论是 。
③若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
④从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
Ⅰ. ;
Ⅱ. ;
(4) 自然界中铁矿石主要有赤铁矿和磁铁矿,应用高炉能冶炼制得金属铁。Fe3O4在高炉中有下列反应:Fe3O4 + CO == 3FeO + CO2
反应形成的固体混合物(FeO、Fe3O4)中,元素氧和铁的质量比用m(O)∶m(Fe)表示。设Fe3O4被CO还原的质量分数为x,则x与混合物中m(O)∶m(Fe)的关系式(用含m(O)、m(Fe)的代数式表示):x= 。
25、(10分)在一定容积的密闭容器中,进行如下化学反应:CO + H2O(g) CO 2+ H2。其化学平衡常数K与温度T的关系如下表:
CO 2+ H2。其化学平衡常数K与温度T的关系如下表:
|
T(℃) |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的逆反应为 (填吸或放)热反应。
(2)判断该反应到达平衡的依据是 (填字母代号)
A、容器内压强不变 B、混合气体中c(CO)不变
C、v 正(H2)= v逆(H2O) D、c(CO)== c(CO2)
E、K值不变 F、c(CO)/ c(H2O)不变
(3)在一体积为10 L的容器中,通入一定量的CO和H2O,在T1℃时发生反应。
①CO和H2O的浓度变化如下图所示,则在0~ 4 min时正反应的平均反应速率为
 v(CO)= 。
v(CO)= 。
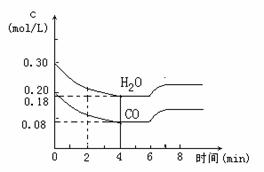 ②此反应的温度 (填大于、小于或等于)830℃。
②此反应的温度 (填大于、小于或等于)830℃。
③图中6min~7min之间浓度发生变化的原因可
能是: 。
A、只充入水蒸气 B、只降低温度
C、只使用催化剂 D、只充入惰性气体
E、增大压强 F、只充入CO2
(4)830℃时,起始浓度c(CO)= a mol/L,
c(H2O)= b mol/L,平衡时c(H2)= c mol/L。
则: ①a、b、c 之间的关系是 。② 当a= b时,a = c
24、(8分)GaAs是一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第IIIA族,As位于周期表的第VA族。
(1)Ga和As的核电荷数分别是 。
(2)GaAs中Ga和As的化合价分别是 。
(3)第IVA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为 ,C和Si原子之间形成 键,在该化合物的晶体中,1个C原子与 个Si原子相连。
(4)写出能说明碳酸的酸性大于硅酸的酸性的离子反应方程式 。
(四)红色沉淀探究
该同学设计了四种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
方案Ⅲ:称得干燥坩埚a g ,取红色粉末置于坩埚中再称得质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为c g,比较a、b、c的关系。
方案Ⅳ:装置如右图所示:(夹持仪器略去)
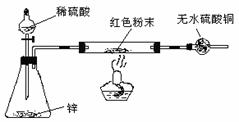 试回答下列问题:
试回答下列问题:
(1) 请你评价方案Ⅰ和方案Ⅱ。如果你认
为该方案合理,请简述其工作原理;
如果你认为该方案不合理,请简述原因。
。
(2)方案Ⅲ中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
(3)方案Ⅳ中,实验前应检验装置气密性,请简述如何检验。
。
(4)方案Ⅳ中,要测定红色粉末的成分,必须测定下列哪些物理量 (填序号)。
①通入氢气体积 ② 反应前,红色粉末+双通管的总质量 ③实验前干燥管的质量④完全反应后,红色粉末+双通管的总质量 ⑤双通管的质量 ⑥ 锌粒质量 ⑦ 稀硫酸的物质的量浓度 ⑧实验后干燥管的质量 ⑨实验条件下的大气压强和室温
(5)有人提出,在氢气发生器与双通管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由
。
(三)制备红色沉淀:①制备氢氧化铜悬浊液②氢氧化铜悬浊液与葡萄糖共热。③过滤、洗涤、低温烘干得红色粉末。
(二)查阅资料:①Cu2O属于碱性氧化物; ②Cu+在酸性条件下能发生自身氧化还原反应;③在空气中灼烧Cu2O能生成CuO。
(一)提出猜想: 。
21、(4分)现有长、宽、厚都一样的两块金属片,已知一块是铝片,另一块是铁片,请用四种物理方法加以鉴别:
① 。② 。
③ 。④ 。
22、(13分)已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)mCO3·n H2O,假设药品中的其它成份受热不分解,不溶于水且不与稀硫酸反应。某研究性学习小组设计了如下实验探究铝碳酸镁片的组成。
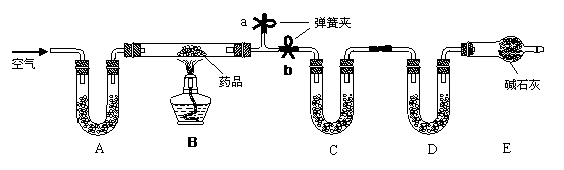 [实验一]取m g该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g ,装置D增重0.44g 。
[实验一]取m g该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g ,装置D增重0.44g 。
⑴ 装置C和D中盛放的药品是:C___________ D_____________
(2) 实验开始前先通入一段时间空气,其目的是______________________________,其操作方法是___________________。当B处的酒精灯点燃后以及反应结束后一段时间内仍然要通入空气的目的是____________________。
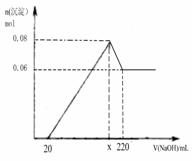 [实验二] 另取m g该药片,加入100mL1mol/L的稀硫酸,充分反应后滤去不溶物,向滤液中逐渐加入1mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
[实验二] 另取m g该药片,加入100mL1mol/L的稀硫酸,充分反应后滤去不溶物,向滤液中逐渐加入1mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
(3)根据以上所给数据求出x=____________
(4) 通过计算确定铝碳酸镁的化学式为________________
(5) 有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是___________________________。
(6)有同学认为,不需要做实验一,只需要在实验二的基础上再得知两个数据就可以求出铝碳酸镁的化学式,你认为这两个数据应该是:_______________________、______________
23、(14分)某同学对课本实验结论:“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了研究。
20、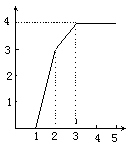 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为:
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为:
A.1∶1∶4 B.1∶3∶1
C.3∶3∶8 D.1∶1∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com