
题目列表(包括答案和解析)
42.用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA
B. 1molCH3+(碳正离子)中含有电子数为10NA
C. 2.4g金属镁与足量的盐酸反应,转移电子数为2NA
D.12.4g白磷中含有磷原子数为0.4NA
41.下列指定微粒的个数比为2:1的是
A. Be2+离子中的质子和电子 B.21H 原子中的中子和质子
C.NaHCO3 晶体中的阳阴离子 D. BaO2固体中的阴离子和阳离子
40.常温常压下,有 CO和 H2 的混合气 12L ,将它再和 12L O2 混合后,使其完全燃烧,恢复到起始温度和压强。请根据下列数据,求混合气体中 V(CO) : V(H2)的值。
(1) 若燃烧后气体体积为 12L ,则原 V(CO) : V(H2)为若干?
(2) 若燃烧后气体体积为 a L ,则原 V(CO) : V(H2)为若干?
(3) 若燃烧后气体体积为 a L ,则a的取值范围上下限各是多少?
(1) 1 : 1 (2)a-6/18-a (3) 6 ≤a≤18
39.从手册上查得:H - H、Cl - Cl和H - Cl的键能分别为 436、243和431 kJ·mol-1,请用此数据估计,由Cl2、H2生成 1mo lH-Cl时的热效应
A.放热 183 kJ· mol-1 B.放热 91.5 kJ· mol-1
C.吸热 183 kJ· mol-1 D.吸热 91.5 kJ· mol-1
38.在相同的温度和压强下,4个容器中分别装有4种气体。已知各容器中的气体和容器的容积分别是a. CO2,100 mL;b. O2,200 mL;c. N2,400 mL;d. CH4,600 mL。则4个容器中气体的质量由大到小的顺序是
A.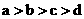 B.
B.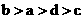 C.
C.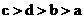 D.
D.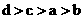
37.今有浓度均为3 mol·L-1的盐酸和硫酸各100 mL,分别加入等质量的Fe粉,反应完毕生成气体质量比为3∶4,则加入盐酸中铁粉的质量为
A.5.6 g B.8.4 g C.11.2 g D.16.8 g
36. NA表示阿伏加德罗常数,以下说法中正确的是
A.2.3 g钠由原子变为离子时失去的电子数为NA
B.在常温常压下,1 mol氩气含有的原子数为2NA
C.标准状况下2.24 L氨气所含电子总数为NA
D.62 g Na2O溶于水后所得溶液中含有O2-离子数为NA
35.()合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1m3(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
|
气体 |
CO |
H2 |
N2 |
O2 |
|
体积(L) |
25 |
60 |
15 |
2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
(1)133.9 (2)3m3<V<4m3
(3)VO2/VH3=(7.5+2.5)/15=2/3
(4)(3X+4aY)/[(1-a)Y]=3/1 X/Y=1-7/3a
34.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料。19.2g纯铜粉理论上可制得纯净硝酸铜晶体的质量为
A.28.2g B.56.4g C.64.2g D.72.6g
33.(某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A.10% B.15% C.20% D.25%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com