
题目列表(包括答案和解析)
52.下列两种气体的分子数一定相等的是
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温等体积的O2和N2 D.等压等体积的N2和CO2
51.设NA为阿佛加德罗常数,下列叙述中正确的是
A.46 g NO2 和 N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2 中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
50.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
49.下列实验操作中,错误的是
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解
B.铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次
D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
48.测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算硫酸铜结晶水的含量。请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是 。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答: 。
(3)实验步骤⑥的目的是 。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号): 。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
(1)研钵、托盘天平、酒精灯(答与不答火柴,不给分不扣分)(2)冷却 防止吸水(3)检验样品中的结晶水是否已经全部除去(4)A、C
47.下列叙述正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
46.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.标准状况下,2.24L苯中约含有3.612×1023:个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1O23个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol CH4中约含有3.01×1024个电子
45.下列说法中不正确的是 A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1 C.32g氧气所含的原子数目为2×6.02×1023 D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
44.下列说法正确的是
A.pH=2和pH=1的溶液中c(H+)=1:10
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C.0.2mol·L-1与0.1mol·L-1醋酸溶液中c(H+)之比为2:1
D.NO2溶于水时,被氧化的与被还原的n(NO3-)之比为3:1
43. 20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中不正确的是
A. 25℃时,饱和KCl溶液的浓度大于4.0mol·L-1
B. 此溶液中KCl的质量分数为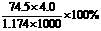
C. 20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D. 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com