
题目列表(包括答案和解析)
4.硫酸铜遇到黄铁矿(FeS2)可以发生反应: 14CuSO4 + 5FeS2 + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4 ,在该反应中,被氧化的硫原子与被还原的硫原子的物质的量之比为:
A. 7:3 B. 3:7 C. 7:5 D. 5:7
3.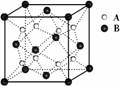 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
A.B2A B.BA2
C.B7A4 D.B4A7
2. 同温同压下,对于等体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体,下列说法正确的是:
A.含相同的分子数和原子数 B.含相同的分子数和电子数
C.含相同的质子和中子数 D.所含分子数和质量均不相同
1.某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验食盐中是否含碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
24.(10分)
白色粉末A由NaNO3、Na2SO3、Na2SO4三种物质中的二种混合而成。取A样品,投入100 mL 2.2 mol/L硫酸(过量)中,使它们在密闭容器中充分反应。反应后测得,反应中产生的无色气体不能使品红溶液褪色,该气体遇空气变为红棕色;反应后的溶液中只含有一种酸根阴离子,且其物质的量浓度为3.1 mol/L。(设反应后溶液的体积仍为100mL)
(1)反应后溶液中酸根阴离子的化学式为______________。
(2)反应的离子方程式为____________________________________________________。
(3)原A样品中是否有Na2SO4?__________(填“有”或“没有”)
(4)原A样品中含有的各物质的物质的量分别为多少?(要求简单运算)
23.(7分)
为了测定铜银合金的成分,将30.0g合金溶于80ml 13.5mol/L的浓HNO3中,合金完全溶解后,收集到6.72L(换算成标准状况且不考虑N2O4)气体,并测得溶液PH=0,假设反应后溶液的体积仍为80mL,试计算
(1)被还原的HNO3的物质的量
(2)合金中Ag的质量分数
22.(13分)下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A~E和F~J中分别含有同一种元素。反应E→A+O2的条件未标出。
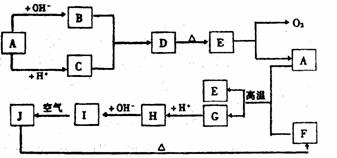
请填写下列空白:
(1)化合物H中的阳离子是 ;D的化学式为 。
(2)A生成B反应的离子方程式是 。
(3)A和F的混合物叫做 ,发生反应的化学方程式是 。
(4)写出B与C生成D的离子方程式 。
(5)I→J反应的化学方程式是 ;该反应过程中发生的现象是 。
21.(11分)
A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其最简式分别为BA和B2A;A与D可形成气态化合物DA和DA2;A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈现弱酸性;B与D可组成一种极易溶于水的碱性气体X,B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等,Y分子中的电子数与最简式为BA的液态化合物的电子数相等。请回答:
(1)写出四种元素的符号:A ,B ,C ,D ;
(2)B4A3D2的化学式为: ,其水溶液显酸性的离子方程式为: ;
(3)已知液态X和B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为: ;
(4)已知Na与X反应和Na与B2A相似,写出Na与X反应的化学方程式:
。
20.(13分)
为测定碳酸钠、氯化钠混合物中碳酸钠的质量分数,拟使用如下图实验装置,测定一定量样品和酸反应放出二氧化碳气体的质量。现提供以下药品:氢氧化钠溶液、澄清石灰水、蒸馏水、浓硫酸、稀硫酸、无水氯化钙、碱石灰。实验步骤如下:
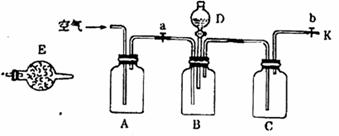
①称量药品,记录样品质量为m1g;
②检验整套装置的气密性,并在相关的仪器中装入相应的药品;
③……
④分别称量仪器E未装药品时和装入药品后(连用药品)的质量,记录所装药品质量为m2g,并把仪器接到K处;
⑤……,把分液漏斗上的玻璃塞打开,旋转活塞,使D中的液体缓慢滴下与B中的样品充分反应;
⑥打开弹簧夹a,通入空气;
⑦拆下仪器E,称量E中所装药品的质量,记录数据为m3g;
请回答下列问题:
(1)A、C、E仪器中装入的药品是:
A ,C ,E
(2)步骤③的操作是 。
(3)步骤⑤中打开分液漏斗上的玻璃塞,旋开活塞并滴入溶液之前,应进行的操作是 。
(4)步骤④中使用D中液体滴到什么时候(看到什么现象时),并闭分液漏斗的活塞: 。
(5)步骤⑥通入空气的目的是 。
(6)该实验测得样品中碳酸钠的质量分数的计算公式是(列出算式,不需化简)
。
19.(10分)
现学生实验需要用480ml 0.1mol·L-1碳酸钠溶液。则应用托盘天平称取十水合碳酸钠晶体(Na2CO3·10H2O) g(设5g以下使用游码)进行配Na2CO3溶液。
若称量时砝码与晶体位置颠倒,则平衡后实际称得的样品质量为 g。配制碳酸钠溶液时需要用到的仪器有 。
下列操作会使溶液物质的量浓度偏低的是 。
A.没有将洗涤液转移到容量瓶中 B.容量瓶洗净后未经干燥处理
C.转移过程中有少量溶液溅出 D.加水时,水的量超过了刻度线
E.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com