
题目列表(包括答案和解析)
21.(5分)
(1) 。
(2) 。
28.(7分)(1)自然界中往往存在许多有趣也十分有意义的现象,下表列出若干化合物的结构、分子式、相对分子质量和沸点。
|
结构简式 |
分子式 |
相对分子质量 |
沸点/℃ |
|
①HO-H |
H2O |
18 |
100 |
|
②H3C-OH |
CH4O |
32 |
64 |
|
③H3CCH2OH |
C2H6O |
46 |
78 |
|
④HOCH2CH2OH |
C2H6O2 |
62 |
198 |
|
⑤H3CCOCH |
C3H6O |
58 |
56 |
|
⑥H3CCH2CH2OH |
C3H8O |
60 |
97 |
从沸点看,可以说明哪些问题?试写出3点:A ,B ,C 。
(2)已知-NH2连在苯环上显碱性。-CO-NH2连在苯环上显中性。分子式为C7H7NO2的有机物中,其分子结构中有一个苯环,两个侧链(假定处于对位)。试写出4种同分异构体A、B、C、D。具体要求:A既有酸性,又有碱性;B只有酸性;C只有碱性;D显中性。
A. B. C. D.
高三化学第一次周六测试答案卡
班级: 姓名: 座号: 评分:
27.(12分)八角茴香含有一种抗亚洲禽流感病毒的重要成分莽草酸(分子量不超过180), 莽草酸是目前世界上被证明是对抗禽流感的唯一良方--达菲的原材料。现取17.4g草莽酸在过量的氧气中点燃,使草莽酸中充分燃烧,将产生的气体通过装足量浓硫酸的洗气瓶,洗气瓶增重0.9g;再将剩余气体通过装足量碱石灰的干燥管,干燥管增重30.8g。
(1)请计算莽草酸的分子式。
(2)若草莽酸存在含双键的六元碳环,含有三个相邻的羟基,羧基连双键碳且在中间一个羟基的对位上。则草莽酸的结构式为 ,下列关于莽草酸的说法正确的是 。
A.该化合物可以使溴水褪色
B.该化合物既具有酸性,又具有碱性
C.该化合物既可发生消去反应、也可被催化氧化生成醛
D.该化合物的分子中处于同一平面的原子只有4个
E.1mo1莽草酸可分别与4mo1金属钠和1mo1NaHCO3充分反应。
(3)草莽酸有很多同分异构体。其中同时满足以下三个条件的同分异构体至少有10种:
①同时含有酯基和碳碳双键,②酯基直接连在双键碳上,⑧含六元碳环。其中碳碳双键上不连羟基的同分异构体的结构简式为: 。
26.(9分)某校化学小组学生进行“气体相对分子质量的测定”的实验。操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量。数据见下表(已换算成标准状况下的数值)。
|
气体 |
A |
B |
C |
D |
E |
F |
|
烧瓶和气体的总质量(g) |
48.4082 |
48.4082 |
48.4082 |
48.3822 |
48.4342 |
48.8762 |
已知标准状况下,烧瓶的容积为0.293L,烧瓶和空气的总质量是48.4212g。空气的平均相对分子质量为29。A、B、C、D、E、F是中学常见的无色气体。
(1)上述六种气体中,能够使品红溶液褪色的是(写化学式) 。
(2)E的相对分子质量是 。
(3)实验室制取D的化学方程式是 。
(4)A、B、C可能的化学式是 。
25.(12分) 生产重铬酸钠的专业厂是用铬铁矿(主要成分是Cr2O3、FeO,还有一定量的Al2O3等)为原料的,其生产过程如下:
(1)Cr元素所在周期表中的位置
(2)在特制熔炉中将铬铁矿和过量纯碱混合,在1100℃左右通空气进行氧化:Cr2O3发生反应的化学方程式: Cr2O3 + Na2CO3 + O2 == Na2CrO4 + CO2↑
Al2O3发生反应的化学方程式: 。
(3)经上述过程后的反应料(称熟料),冷却后用水浸取,其中可溶性的物质主要有 ,不溶性杂质经过滤后除去。
(4)为了除去滤液中的铝元素,用稀硫酸将溶液中和至pH为7-8,其反应的离子方程式为 。
(5)除去铝元素后的滤液,再用稀硫酸调到pH为2-3,这时可得Na2Cr2O7溶液,其反应方程式为:
Na2CrO4 + H2SO4 -- + +
(6)请简述在实验室中可通过哪些操作可除去溶液中所混有的硫酸钠晶体,从而得到较纯的重铬酸钠溶液。(已知硫酸钠的溶解度随温度的变化较大,而重铬酸钠变化较小。)
24.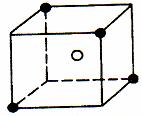 (10分)某晶体的最小结构单元如图所示,X(●表示)位于立方体的顶点,Y(○表示)位于立方体的中心。
(10分)某晶体的最小结构单元如图所示,X(●表示)位于立方体的顶点,Y(○表示)位于立方体的中心。
(1)该晶体的晶胞中平均占有的X原子有 个; Y原子的配位数为 。这些X原子组成的构型是 。
(2)若该晶体中还含有Z元素,Z未标出,其化学式为XY2Z6,且互相距离最近的Z原子组成一个正八面体。Z在上述晶体结构单元中的位置是 。
(3)若用a表示晶胞边长(cm),ρ表示密度(g/cm3),NA表示阿伏加德常数,则该晶体的相对分子质量表达式为 。
23.(12分)氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:
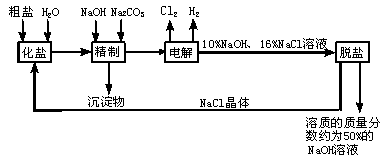
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上发生反应方程式为 ,与电源负极相连的电极附近,溶液的pH___________________。(选填不变、升高或降低)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是 。(选填A、B或C)
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42- ,加入试剂的合理顺序为__________,(选填A、B或C)
A.先加入NaOH,后加入Na2CO3,再加入钡试剂
B.先加入NaOH,后加入钡试剂,再加入Na2CO3
C.先加入钡试剂,后加入NaOH,再加入Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________________、冷却、____________________(填写操作名称)除去NaCl。
(6)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应。若采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则电解过程的化学方程式可写为_______________________________________________________。
22.(13分)向溴水中加入足量乙醛溶液,可以看到溴水褪色。对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
(1)方案一是否可行? 理由是 。
(2)假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)= mol则说明溴水与乙醛发生取代反应。若测得反应后n(Br-)= mol则说明溴水与乙醛发生加成反应,若测得反应后n(Br-)= mol则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比为1∶5配制1000mL KBrO3一KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2。取该溶液10mL,加入足量乙醛溶液使其褪色,然后将所得溶液稀释为100mL,准确量取其中的10mL,加入过量AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生的反应为上述猜想中的 (填序号)。
(4)写出上述测定过程中反应的离子方程式。
①KBrO3与KBr在酸性条件的反应:
②溴水与乙醛反应:
(5)根据上述信息,试推测向酸性KMnO4溶液中滴加乙醛可能出现的现象:
21.(5分)利用右图所示的装置,可以验证NH3和HCl 的有关性质。实验前a、b、c活塞均关闭。
(1) 通过挤压胶头滴管和控制活塞的开关,若要在 烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是 。
(2) 通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是 。
20.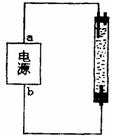 某学生想制作一种家用环保消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使氯气被完全吸收制得有罗强杀菌能力的消毒液,设计了如右图所示的装置,则对电源电极名称和消毒液的主要成分判断正确的是
某学生想制作一种家用环保消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使氯气被完全吸收制得有罗强杀菌能力的消毒液,设计了如右图所示的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;NaClO和NaCl
D.a为阴极,b为阳极;NaClO和NaCl
第Ⅱ卷(共80分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com