
题目列表(包括答案和解析)
23.(10分)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上述元素中处于第VA族的有 ,处于第二周期的有 (以上均用编号表示)。
(2)上述元素中金属性最强的是 (用编号表示)。
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 。
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n–m)≥ 0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n–m)< 0时,该元素属于非金属元素。试回答:
a.第n(n≥ 2)周期有 种非金属元素(含零族元素)。
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素)。还有 种未发现,未发现的非金属处在第 周期第
族(注:将零族看作VIIIA族)。
22.(8分)氰(CN)2的结构简式为N≡C-C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2和水反应可生成HCN和HCNO;(CN)2的氧化性比Br2弱,比I2强。
(1)下列有关反应的化学方程式不正确的是 (填选项标号)。
A.(CN)2和NaOH溶液反应:(CN)2+2NaOH=NaCN+NaCNO+H2O
B.MnO2和HCN反应:MnO2+4HCN △ Mn(CN)2+(CN)2↑+2H2O
C.向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2NaBr=2NaCl+Br2
(2)HCN的电子式为 。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O
上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.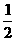 C.2 D.不能确定
C.2 D.不能确定
②若d=e=1, 则b= 。
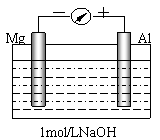
21.(10分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
20.(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
 (5)根据上述实验事实确定:①该溶液中肯定存在的离子是
;②肯定不存在的离子是
;③还不能确定是否存在的离子是
。
(5)根据上述实验事实确定:①该溶液中肯定存在的离子是
;②肯定不存在的离子是
;③还不能确定是否存在的离子是
。
19.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
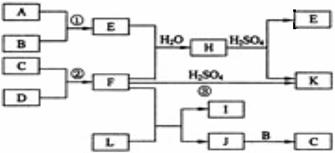
请按要求填空:
⑴反应③的化学方程式______________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
18.(9分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
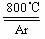 TiO2 +2C+2Cl2
TiO2 +2C+2Cl2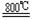 TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中反应的离子方程式为__________________________________ 。
⑶ 装置D中冷凝管进水口的位置是(填a或b)________。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为_____________________________。
17.(13分)(1)下列实验操作或对实验事实的叙述中存在错误的是 (填序号)
A.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液中,过一会儿取出,与标准比色卡进行对比
B.测定硫酸铜晶体的结晶水含量时,加热过程中有晶体飞溅出来会造成结果偏低
C.中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
D.红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2~3滴即可
E.托盘天平称取10.50g干燥的NaCl固体
F.验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
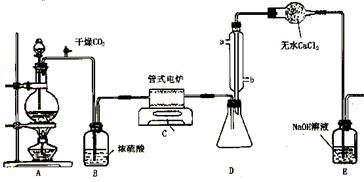
(2) 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
Ⅰ.用如图所示装置进行Mg和SO2的实验。
① 选择制取SO2的合适试剂____________。
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④CaSO3固体
② 写出装置B中发生的主要反应的化学方程式_______________________________。装置C中
NaOH溶液的作用是____________________________。
③ 你认为该装置是否有不足之处?__________。如果有,请一一说明______ ______
____________________________________________________________。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si
②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
④ 该小组“实验室制Si”的化学方程式是_____________________ _____________
__________________________________________________。
⑤ 你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是___________
___________________________________________________________________。
16.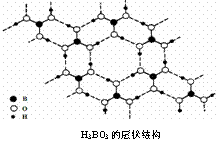 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是:
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是:
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
15.近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为KI+H2O→KIO3+H2↑。下列有关说法中,正确的是
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
14.下列说法中正确的是
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石);△H=+11.9kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol
H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.3 kJ
D.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学
方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=+285.8kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com