
题目列表(包括答案和解析)
13.时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含 I浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度. 主要步骤如是 :
①在中性溶液中,用溴将试样中l-氧化成lO3- ,将过量的溴除去。
②再加入过量的Kl,在酸性条件下,使lO3-完全转化成l2。
③将②中生成的古典完全萃取后,用肼将其还原成l- ,方程式为:N2H4+2l2= 4l-+N2+ 4H+ ④将生成的l-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的 KI溶液 ,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂 ,用Na2S203 标准溶液滴定 , 方程式为 :
2Na2S203+l2=Na2S406+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中l-浓度的(设放大前后溶液体积相等)
A.2 倍 B.4 倍 C.6 倍 D.36 倍
11. 某无色溶液与NH4HC03作用能产生气体,此溶液中可能大量共存的离子组是 A. C1-、 Mg2+ 、H+ 、 Zn2+ 、S042- B. Na+ 、 Ba2+ 、 N03-、 OH- 、 SO42-
C. MnO4-、K+ 、Cl- H+ S042- D. K+ N03-、S042- 、OH- Na+
12 下列各组物质问反应可能包括多步反应 , 其总的离子方程式正确的是 :
A. NaC1O (aq) 中通入少量 CO2: C1O + CO2 + H20 = HClO +HC03
B. FeCI2在空气中被氧化: 4Fe2++O2+2H20=4Fe3++40H-
C. A1CH3(aq)中投入过量Na:A13++4NA+2H20 = A102 + 4Na++ 2H2 ↑
D. FeBr2(aq)中通入少量C12:2Fe2++4Br+3C12= 2Fe3++2Br2+6C1-
①常温常压下, 17g 甲基 (-14CH3) 所含的中子数为9NA
②常温常压 22.4L NO气体的分子数小于NA
③ 64g 的铜发生氧化还原反应 , 一定失去2NA个电子
④常温常压下 , 100mL 0.5mol/L 的乙酸溶液中 , 乙酸的分子数目小于 0.05 NA
⑤标况时 , 22.4L 二氯甲烷所含有的分子数为4NA
⑥常温常压下, 1mol 氯气含有的核外电子数为4NA
A. ①② B. ③④ C ②④ D.⑤⑥
10. 某无色气体可能由 O2 、 CO2 、 HCl、NH3 、NO 、 Br2 中的一种或儿种
组成 , 通过图中洗气瓶后气体体积减少 , 通过干燥管后气体呈红棕色 , 则
下列推断正确的是:
A 干燥管内固体为碱石灰 B 原气体中一定有 NO 和 O2
C. 原气体中一定有NH3 、NO 、CO2 D. 原气体中一定没有 HC1、 Br2
8. 下列各选项所述的两个量 , 前者一定大于后者的是:
① F2 和 Br2 的沸点 ②纯水在 25 ℃ 和 80 ℃ 时的 pH 值
③同温下分别在1OOg水中最多能溶解的无水 CuSO5和 CuSO5· 5H2O的质量
④ 25 ℃ 时 ,等体积的 pH 值都等于3的盐酸和 AICL3溶液中 ,已电离的水分子数
⑤在NH3+NO→ N2十H20 反应中 , 被氧化和被还原的 N 原子数
⑥耐火材料 MgO 和 CaO 的熔点
⑦ H-和H+离子半径
⑧金刚石晶体和石墨晶体中 , 每个最小碳环里所含的实际碳原子数
A ①②⑥ B ①②③⑤ C ⑤⑥⑦ D ②⑥⑦
7. (NH4) 2PtCl6 晶体受热分解 , 生成氮气、氯化氢、氯化铵和金属铂。在此分解反应中 , 氧化产物与还原产物的物质的量之比是:
A. 1: 2 B. 1: 3 C. 2: 3 D. 3: 2
6. .己知 CUS04 溶液分别与 Na2C03 溶液、 Na2S 溶液的反应情况如下 :
(1) CUS04 十 Na2C03 主要 : Cu2+ + C032- H20 ==CU(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- == CuC03 ↓
(2) CUS04 +Na2S 主要 : Cu2+ +S2- == CuS ↓
次要 : Cu2+ + S2- +2H20==Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中 , 正确的是
A. CuS <Cu(OH)2<CuC03 B. CuS >Cu(OH)2>CuC03
C. Cu(OH)2>CuC03>CuS D. Cu(OH)2<CuC03<CuS
5. 目前人类已发现的非金属元素除稀有气体外 , 共有 16 种 ,下列对这16种非金属元素的相关判断:
①都是主族元素 , 最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氧化物常温下都是气态 , 所以又叫都气态氢化物
④氧化物常温下都可以与水反应生成酸
A 有①②正确 B. 只有①③正确
C. 只有③④正确 D. ①②③④均不正确
4. 测定相对分子质量的常用方法之一是凝回点下降法。例如水是常用的溶剂 , 当水中溶解了某种不挥发的溶质时 ,水的凝固点 (即冰点) 即会下降 , 海水在 0℃时不会结冰就是这个原因。凝固点下降的程度与溶质的分子数有关 ,而与溶质是何种物质无关 , 这就是溶液的依数性。当溶剂的量确定时 , 凝固点的降低值与溶质分子数成正比。己知 10.0 g 樟脑中
溶解 0.412 g萘 , 凝固点下降了13 °C, 即么 , 组成为 C7H602 的有机物 0.23g 溶于 15.6 g 樟脑中 , 凝固点下降约多少 ( 己知萘相对分子质量为 : 128)
A.5 ℃ B.8℃ C.7℃ D.12℃
3. 2005 年 10 月 12 日我国成功发射了第二艘载人航夭飞船-- " 神州六号 ", 实现了双人
多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射 " 神六 " 时用肼 (N2H4) 作为火箭发动机的燃料 , NO2 为氧化剂 , 反应生成 N2和水蒸气。
已知 : N2(g) + 202(g) = 2N02(g); ΔH = +67.7kJ/mol
N2H4(g) + 02(g) = N2(g) + 2H20(g); ΔH= -534kJ/mol 下列关于肼和 N02 反应的热化学方程式中 , 正确的是
A 、 2N2H4(g) + 2N02(g) = 3N2(g) + 4H20(I); ΔH = - 11 35.7kJ/mol B 、 2N2H4(g) + 2N02(g) = 3N2(g) + 4H20(g); ΔH= -1000.3kJ/mol c 、 N2H4(g) + N02(g) = 3/2N2(g) + 2H20(l); ΔH = -11 35.7kJ/mol D 、 2N2H4(g) + 2N02(g) = 3N2(g) + 4H20(g); ΔH =-1135.7kJ/mol
2. 最近广东北江发生严重的水体铺污染事件 , 专家确定用 1200 吨的聚合铁 { 简称 PFS, 化学式为 : [Fe2(OH)n(S04)3-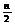 ]m' n<5,m<10} 分批加入 , 利用 PFS 在水体中形成絮状物 ,
]m' n<5,m<10} 分批加入 , 利用 PFS 在水体中形成絮状物 ,
以吸附镉离子。结合题中信息 , 下列说法不正确的是:
A. 10848Cd 核素中中子数为 60
B. 含镉废电池应进行回收处理
C. PFS 中铁显十 2 价
D. 实验室由 FeS04 溶液制 PFS 需经过氧化、水解和聚合的过程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com