
题目列表(包括答案和解析)
2.根据下表中列出的数据,判断下列热化学方程式书写不正确的是
|
化
学
键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1mol化学键时放出的能量 |
436kJ·mol-1 |
243kJ·mol-1 |
431kJ·mol-1 |
A.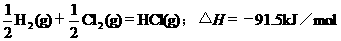
B.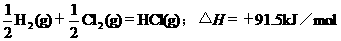
C.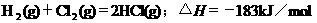
D.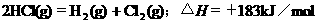
1.下列各原子或离子的电子排布式错误的是
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
25.
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,
K值大小与温度的关系是:温度升高,K值______________(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) 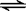 CO2(g)十H2 (g) △H<0
CO2(g)十H2 (g) △H<0
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L·min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态;
C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
25.(本题共8分)
(1) 可逆反应的进行程度越大 可能增大也可能减小
(2) 0.03
(3) ①平衡 > ②d a
19.(8分)⑴ 8 ⑵ N-N的键能较小 ⑶ 13 230kJ ⑷ 用作高能量的炸药或火箭燃料
19.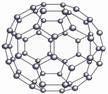 (8分)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
(8分)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
已知E(N-N)=167kJ·mol-1,E(N=N)=418kJ·mol-1,E(N≡N)=942kJ·mol-1。(E表示键能,即打开1mol气态化学键所需要的能量)
回答下列问题:
⑴ N60分子中每个N原子最外层有 个电子;
⑵ N60稳定性较差的原因可能是 ;
⑶ 1molN60受热分解为N2时放出的热量为 ;
⑷ N60潜在的商业用途可能是 。
11.(6分).在室温下,将表面积相同、纯度相同、体积也相同的同种锌片分别投入等体积0.1mol/L的稀硫酸和0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异,投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸的快,运用你所学过的知识分析产生这一现象的原因可能是什么,并设计实验来证明你的推论是正确的。
答案:两者反应的本质都是锌与溶液中的氢离子发生的氧化还原反应,氯离子可能是这一反应的正催化剂或硫酸根离子是这一反应的负催化剂。
实验设计:向锌和硫酸反应的试管中滴加氯化锌溶液(其他溶液不可),若反应速率加快了,则说明氯离子是反应的正催化剂。或向锌与盐酸反应的试管中滴加硫酸锌(其他溶液不可),若反应率减慢了,说明硫酸根离子是该反应的负催化剂。
19.(12分)
(1)Al (2分) H2 (2分)
Mg+2OH--2e-=Mg(OH)2(2分)若写成:Mg-2e-=Mg2+ 得1分
(2)Al+4OH--3e-=AlO2-+2H2O (2分) O2+2H2O+4e-=4OH- (2分) 铝片中含有杂质,构成原电池。(2分)
19.(12分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH 溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:_________________________________________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
18.(10分)(每空2分)
(1)②
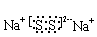 (2)PCl3、CCl4
(2)PCl3、CCl4
(3)S (或硫)
(4)KC8
18.(10分).下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 (10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、 。
(2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、 。
(3)某元素R的原子半径为1.02×10-10m,该元素是 ;化合物Na2R2的电子式为_____________________。
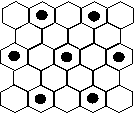
(4)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com