
题目列表(包括答案和解析)
19.(1)(3分)配平以下氧化还原反应方程式:

(2)(3分)家用液化气中主要成份之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量5×105 kJ,试写出丁烷燃烧反应的热化学方程式:
。
18.电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
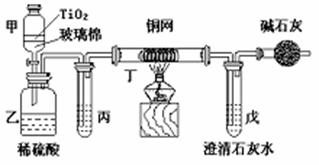
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)(2分)在NaClO与CN-离子第一步反应过程中,被还原的元素是
(2)(2分)甲中反应的离子方程式为 ,
(2分)乙中反应的离子方程式为 。
(3)(6分)乙中生成的气体除N2和CO2外,还有HCl及Cl2等副产物。丙中加入的除杂试剂是饱和食盐水,其作用是 ,
丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
(4)(2分)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。
17.(2分)下列实验操作或设计正确的是 。
A.中和热测定实验中使用大小相同的两个烧杯和容积相等的两个量筒。
B.利用溴水或酸性高锰酸钾证明亚硫酸钠具有氧化性。
C.为确定Na2HPO4与CaCl2溶液反应后生成的白色沉淀是难溶的Ca3(PO4)2 ,还是难溶的CaHPO4,可取反应后的上层清液,测定其pH来判断。
D.用测定熔点的方法确定某物质是纯净物还是混合物。
16.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1∶7 B.1∶9 C.1∶5 D.2∶9
第Ⅱ卷(共52分)
15.标准状况下,用1L水吸收aL氨气后制得浓度为12. 0 mol·L-1、密度为0.915 g·cm-3的氨水。则a的值约为(本题中水的密度以1.00g·cm-3计) ( )
A.12 B.268.8 C.378 D.915
14.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元
素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子
层上的电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合
物的化学式不可能是 ( )
A.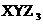 B.
B.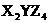 C.
C.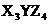 D.
D.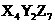
13.下列反应的离子方程式正确的是 ( )
A.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ = Al(OH)3↓+H2O
D.向硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O
12.下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3-、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2-、NO3-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、Cl-、
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO3-、Na+
11.已知反应: ( )
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热等于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应生成2mol水的反应热为ΔH=-114.6kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
10.NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.4 g重水(D2O)中所含质子数为0.2NA
B.在通常状况下,22.4 LH2和4 gHe均含有NA个分子
C.8.0 g Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com