
题目列表(包括答案和解析)
7.下表为元素周期表前四周期的一部分,下列有关表中各元素的叙述正确的是( )
|
|
|
|||
|
|
② |
④ |
|
|
|
① |
③ |
⑤ |
⑥ |
|
|
|
|
|
⑦ |
|
A.原子半径的大小顺序是①>②>③>④ B.⑤的氢化物的沸点高于④的氢化物
C.工业上冶炼①的单质的方法是还原法 D.⑥的阴离子的还原性比⑦的阴离子强
6.等物质的量的下列物质分别与足量的NaOH溶液完全反应,需要NaOH的量最多的是( )
A.NaHSO4
B. AlCl3
C. SiO2
D. HO-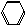 -OOCCH3
-OOCCH3
25、(10分)有一组成为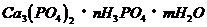 的磷酸酸式盐,取该盐晶体3.78g,加热至100℃以上,失去全部结晶水,残余物重3.51g,另取该晶体3.78g溶于水,须加含2.22 g
的磷酸酸式盐,取该盐晶体3.78g,加热至100℃以上,失去全部结晶水,残余物重3.51g,另取该晶体3.78g溶于水,须加含2.22 g 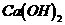 的石灰水才能使之全部转变为正盐。[已知
的石灰水才能使之全部转变为正盐。[已知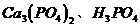 、
、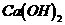 的式量分别为310、98、74]
的式量分别为310、98、74]
求:(1)该晶体组成式中的n、m值。
(2)用酸式盐的形式写出该盐的最简化学式。

24、(8分)能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知在:25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则甲醇的燃烧热为___________________
(2)测定工业甲醇中CH3OH的质量分数可用下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L(NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
23、将适量黄色的草酸亚铁(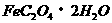 )粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着的木条熄灭,同时生成黑色的铁粉,反应将结束时,用橡皮塞塞好试管,稍冷后,打开塞子将所得的铁粉洒在石棉网上,便会自燃起来。请回答下列问题:
)粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着的木条熄灭,同时生成黑色的铁粉,反应将结束时,用橡皮塞塞好试管,稍冷后,打开塞子将所得的铁粉洒在石棉网上,便会自燃起来。请回答下列问题:
(1)铁粉为什么会在空气中自燃?是因为______________ ____。
(2)写出草酸亚铁受热分解的化学方程式:_________________ _。
22、(10分)(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”)。
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = ____________ mol·L-1 c(H+) - c(MOH) = ______________ mol·L-1
21、(12分)在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入1 L含3mol H2和1 mol N2混合气体,反应达平衡时有a mol NH3生成,N2的转化率为b %。
(1)若在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x mol H2和y mol
N2,反应达平衡时有3a mol NH3生成,N2转化率仍为b %。则x=______;y=_______。
(2)在恒温、恒压和使用催化剂的条件下,设在体积可变的密闭容器中充入x mol H2、y mol
N2和z mol NH3,若达平衡时N2转化率仍为b %,则x、y的关系为_______________,z的取
值范围为_____________。
(3)在恒温(与(1)温度相同)和使用催化剂的条件下,在容积不可变的密闭容器中,充入1 L含3 mol H2和1 mol N2混合气体,反应达平衡时N2的转化率为c %,则b、c的关系为___ (用
“<”、“=”或“>”表示),理由是 。
20.(6分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
(5)根据上述实验事实确定:①该溶液中肯定存在的离子是 ;②肯定不存在的离子是 ;③还不能确定是否存在的离子是 。
19.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
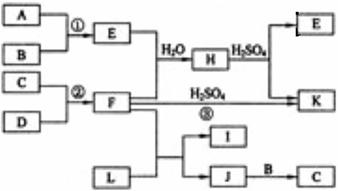
请按要求填空:
⑴反应③的化学方程式___________ ___。
⑵C的结构式____________ __;H的化学式______ ________。
⑶L的溶液与化合物E反应的离子方程式____________ __。
⑷化合物J的化学式_____ _____。
18.(12分)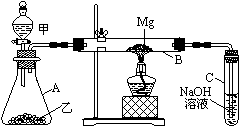 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
Ⅰ.用如图所示装置进行Mg和SO2的实验。
① 选择制取SO2的合适试剂____________。
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④CaSO3固体
② 写出装置B中发生的主要反应的化学方程式
_______________________________ 。
装置C中NaOH溶液的作用是_______________________。
③ 你认为该装置是否有不足之处?__________。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si
②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
④ 该小组“实验室制Si”的化学方程式是:
__________________________________________________。
⑤ 你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是:
___________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com