
题目列表(包括答案和解析)
3.我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
气体A的饱和溶液加入食盐ⅠA和食盐的饱和溶液通入足量气体BⅡ悬浊液过滤Ⅲ晶体Ⅳ纯碱
则下列叙述错误的是
A.A气体是NH3,B气体是CO2
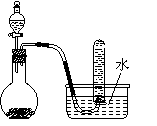 B.第Ⅲ步得到的晶体是发酵粉的主要成分
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
2.下列各物质中,将前者加入后者时,无论前者是否过量,都能用同一化学方程式表示的是
A.浓氨水、硝酸银溶液 B.稀硝酸、铁粉
C.澄清石灰水、碳酸氢钙溶液 D.二氧化硫、饱和碳酸钠溶液
1.一氯氨(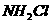 )中氨基离子带负电荷,预计它跟水反应的最初生成物是( )
)中氨基离子带负电荷,预计它跟水反应的最初生成物是( )
A.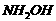 和HCl
B.
和HCl
B.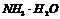 和HCl
和HCl
C.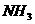 和HC1O
D.
和HC1O
D.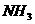 和
和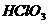
25.(10分)工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,控制一定条件,仅使Fe3+、Cr3+转化为沉淀,使废水中的铬含量达排放标准。现有1 L含有Cr2O72-的酸性工业废水,用上述方法处理后,在阴极上得到0.896 L(标准状况)气体,生成4.24 g 沉淀。
(1) Cr2O72-在酸性条件下与Fe2+ 发生氧化还原反应,生成Cr3+和Fe3+ 。写出该氧化还原反应的离子方程式 。
(2)通过计算,确定处理后的废水中是否存在Cr2O72-。
(3)原工业废水中铬的含量是多少(g/L)?
命题,校对:周春来
24.(8分) Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mo1/L HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的化学方程式___________________________________。
(2)产物中硝酸铜的物质的量__________mol。
(3)如混合物中含0.01 mol Cu,则含Cu2O________mol、含CuO ________mol。
23.(9分) X通常存在于钢铁中,它是由两种常见元素组成的混合物。A、D、H、I、J常温下为气体,H、I、J为单质。反应①为氯碱工业的主要反应,反应③是制备理想绿色水处理剂Na2FeO4(高铁酸钠)的一种方法(图中部分生成物没有列出)。
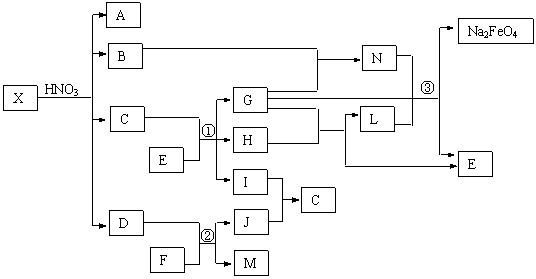
请依据上述物质之间关系回答下列问题:
⑴X中非金属元素的原子结构简图为 ,F的电子式是 ,存在的化学键有 。
⑵写出反应②的化学方程式 ;
反应③的离子方程式 。
⑶若X是由组成元素相同的甲和乙的混合物,甲、乙均是由两种元素原子以最简整数比构成的化合物,其相对分子质量分别为124、180。现测得X中组成元素的质量之比为3∶35,则乙在X中的物质的量分数为 。
22. (8分) 现有下列短周期元素性质的有关数据:
|
元素编号 |
a |
b |
c |
d |
e |
f |
g |
h |
i |
j |
|
原子半径/pm |
111 |
77 |
70 |
104 |
143 |
99 |
117 |
186 |
160 |
64 |
|
最高化合价或 最低化合价 |
+2 |
-4 |
-3 |
+6 |
+3 |
-1 |
+4 |
+1 |
+2 |
-1 |
(1)根据元素周期律确定a至j十种元素在周期表中的位置,将c和e填入下表相应的空格内。
|
主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||
|
1 |
|
|
|
|||||||
|
2 |
|
|
|
|
|
|
|
|
||
|
3 |
|
|
|
|
|
|
|
|
||
(2)上述10种元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)_____ __。
(3) i在b的氧化物中燃烧的方程式为 。
(4) h和d所形成的化合物的电子式为 。
(5)原子数相同,电子总数相同的分子或离子互称等电子体。在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式___________ _ 。
21.(8分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)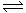 2NH3(g);△H= -92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g);△H= -92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
⑴合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A、采用较高压强(20Mpa~50Mpa)
B、采用500℃的高温
C、用铁触媒作催化剂
D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
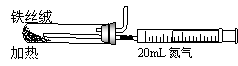 ⑵右图是实验室模拟工业法合成氨的简易装置。
⑵右图是实验室模拟工业法合成氨的简易装置。
简述检验有氨气生成的方法 。
⑶在298K时,将10molN2和30molH2放入合成塔中,
 为何放出的热量小于924kJ?
。
为何放出的热量小于924kJ?
。
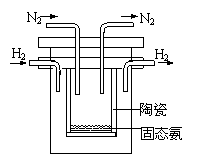
⑷1998年希腊亚里斯多德大学的Marmellos和Stoukides
采用高质子导电性的SCY陶瓷(能传递H+),实现了高温
常压下高转化率的电化学合成氨。其实验装置如图。
阴极的电极反应式 。
20.(12分)(1) 已知HCO3-比HBrO更难电离,但HBrO的酸性弱于H2CO3。写出下列反应的离子方程式:①向小苏打溶液中滴加少量溴水: ;
②向苏打溶液中滴加少量溴水: 。
(2)工业上从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂,方程式未配平):
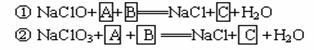
请完成以上化学方程式,
③回答实际生产上采用NaClO3来氧化Fe2+比较合算的理由 。
④NaClO3还能与盐酸反应生成ClO2和Cl2,写出反应的离子方程式: 。
19.(9分 )叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有____________。
a.离子键 b.极性键 c.非极性键 d.金属键
(2)配平下列反应的离子方程式
N3-+ MnO4-+ H+ → Mn2+ + NO + ____
Mn2+是_______产物。产生6.72 L(S·T·P)NO转移的电子为____ mol。
(3)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊。请写出有关反应的化学方程式 ____________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com