
题目列表(包括答案和解析)
1.答案:(1)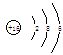 ;
; ;
; ;(每空1分)
;(每空1分)
(2)NaHSO4=Na++H++SO42-、NaHSO4在水溶液中完全电离出氢离子使溶液呈酸性
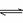 CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性 (每空方程式2分,叙述1分)
CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性 (每空方程式2分,叙述1分)
(3)2H++CO32-=H2O+CO2↑;
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑(每个方程式2分)
1.有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
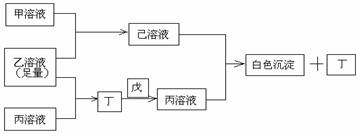
请回答:
(1)写出C元素的原子结构示意图__ ___,写出丁和戊的电子式______、________;
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________________________;
丙溶液呈碱性的原因____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________;
②己溶液+丙溶液→丁______________________________。
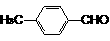
2.已知二氯烯丹是一种播前除草剂, 其合成路线如下:
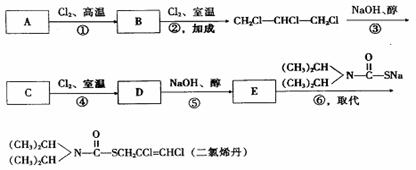
D在反应⑤中所生成的E, 其结构只有一种可能.
(1)写出下列反应类型: 反应①是_____________, 反应③是________________.
(2)写出下列物质的结构简式:
A________________, C_______________,D__________________, E_______________。
1.答案:
(1) A: CH≡CH B: 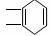 D:CH3CH(OH)CH2COOH
D:CH3CH(OH)CH2COOH
(2)CH3CH=CHCOOH
+ CH3OH 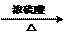 CH3CH=CHCOOCH3 + H2O (主)
CH3CH=CHCOOCH3 + H2O (主)
(3)①③⑥
甲:将锌放入浓盐酸中,反应速率较快
乙:将实验过程记录下来,并交流。
|
|
根据上述资料与交流材料回答下列列问题
⑴乙反应速率明显比甲快,原因是: 。
⑵丙、丁根据铜位于金属活动顺序表氢之后,与盐酸不反应,对乙产生的气体体积比甲大的事实。作出如下推断:
①丙认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是: 。
②丁作了如下猜想,是否成立,请你设计实验方案。
|
丁猜想 |
验证方法 |
预测现象及结论 |
|
丁认为铜片中可能含有锌等杂质 |
|
|
⑶戊注意到乙中(3)中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会析出。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个只设计两个方案):
|
戊 |
预计验证方法 |
预测的现象与结论 |
|
白色沉淀是氯化亚铜 |
|
|
|
|
|
⑷指导老师肯定了戊的猜想,请结合资料③,写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体,化学方程式可能是: 。
乙的实验步骤(3)稀释,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系:
(用离子方程式表示)。
⑸就铜与浓盐酸反应若进一步探讨,你认为下一步实验方案: 。
5、已知: 4NH3十5O2  4NO+6H2O
4NO十3O2十2H2O=4HNO3
4NO+6H2O
4NO十3O2十2H2O=4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)amolNO完全转化为HNO3需要氧气_______ mol。
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为________(保留2位小数)。
(3)20.0mol的NH3用空气氧化,产生混合物的组成为:NO18.0mol、O212.0 mol、N2150.0 mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
(4) 20.0mol 的NH3和一定量空气充分反应后,再转化为HNO3。
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125mol≤n(B)≤200mol时,n(A)和n(B)的关系式______________________。
[答案](1)0.75a mol (2)0.14 (3)氨转化为NO的转化率为97.5%;氨转化为HNO3的转化率为7.5%
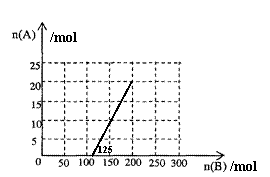 (4)①
(4)①
②3n(A)=0.8[n(B)-125][125mol≤n(B)≤200mol]
4、已知一个碳原子上连有两个羟基时,易脱水形成碳氧双键。请根据下图回答。
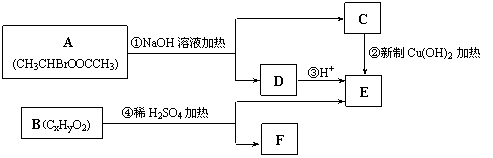
(1) E中含有的官能团的名称是_____________,反应②的反应类型是_____________,
C跟新制的氢氧化铜反应的化学方程式为 。
(2) 已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为_____________,F的分子式为______________。
(3) 在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11 μm线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
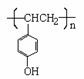
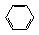
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________种结构,写出其中任一种同分异构体的结构简式________________。
(1) 羧基;氧化反应;CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O(2) C10H10O2;C8H8O;

(3) n HO- -CH=CH2
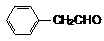
(4)四; 、
3、科学家预测“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为( )
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ
C.2H2(g) + O2(g) = 2H2O(l);△H =-571.6kJ
D.H2(g) + 1/2O2(g) = H2O(g);△H = -285.8kJ
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是 。
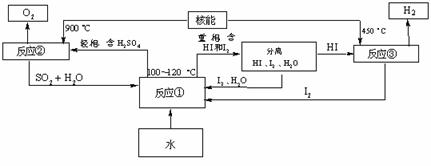 (3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘。
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘。
请写出反应①的化学方程式: 。
用硫-碘热循环法制取氢最大的优点是 。
(4)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的两点理由。
答案:(1)B (2分)(2)循环过程需要很高的能量,且使用重金属汞,会产生污染。 (2分)
(3) SO2+I2+2H2O 2HI+H2SO4 (2分)SO2和I2可循环使用,无污染。 (2分)
2HI+H2SO4 (2分)SO2和I2可循环使用,无污染。 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。
或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。
2、部分单质和化合物的转化关系如图(有关反应条件及部分反应物或生成物已略去),已知:C、D、E、F均为单质,B、C、D、E在常温常压下是气体;反应②在工业上常用于检验C;J、K均为不溶于水的沉淀,其中J为红褐色。
请回答下列问题:
(1)A的电子式:_______________;(2)反应①的化学方程式是________________________;
(3)H→I的离子方程式是____________________________________;
(4)写出工业上用反应②检验C的操作步骤及相关现象: ___________________________;
(5)当有1.12L(标准状况)D生成时,反应①中转移的电子数为___________;
(1)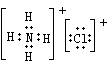 (2)2NH4Cl
(2)2NH4Cl H2↑+Cl2↑+2NH3↑(3)2Fe2+ +Cl2=2Fe3+ +2Cl-
H2↑+Cl2↑+2NH3↑(3)2Fe2+ +Cl2=2Fe3+ +2Cl-
(4)用浓氨水靠着氯气管道移动,若有白烟出现,说明此处氯气泄漏(5)0.1NA(或6.02×1022)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com