
题目列表(包括答案和解析)
1、下列物质:①大理石 ②生石膏 ③铁锈 ④蛋壳,分别滴加食醋时能产生气体的是
A. ①④ B. ①② C. ①②④ D.②③④
25.(10分)二甲醚(CH3OCH3)是一种新型的合成“柴油”。它可由生物甲烷或天然气合成。
 (1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
(1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
(C6H10O5)n+nH2O 3nCH4↑+3nCO2↑,若某植物纤维素(C6H10O5)n的含量为10%,某沼气池,当加入该植物162kg,在微生物作用下完全转化可得CH4在标准状况下的体积为__________________m3。
(2)合成二甲醚主要步骤为造气和合成。过程如下:
|
|

若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其它杂质,每100m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2且体积比为4:1,下同),才能保证合成时CO和H2充分利用。V[H2O(g)]=________m3;V(空气)=_________m3。
(3)为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O→CO+3H2 ②2CH4+O2→2CO+4H2
合成塔I:CO+2H2→CH3OH,2CH3OH→CH3OCH3+H2O;
合成塔II:N2+3H2  2NH3
2NH3
假设天然气中只含CH4,反应②中通入适量空气,通过调节①和②中投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰为3:1,以便合成氨。该企业每生产34tNH3理论上同时可以得到二甲醚多少吨(设工业经多次转化,总转化率假定为100%,设合成塔I中水与CO不反应)?
24.(8分)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
回答下列问题:
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
23.(10分)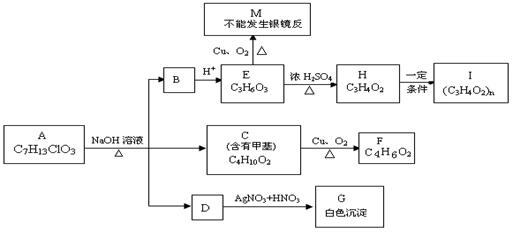 从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
(1)A的结构简式: ;
(2)写出反应类型: E→H 、H→I ;
(3)写出C→F的化学方程式: 。
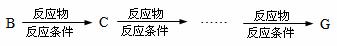
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图(有机物用结构简式表示,必须注明反应条件)。
提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
22.(8分)有机物A与CH3COOH无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答下列问题。
(1)符合条件的相对分子质量最小的有机物A是 。(写结构简式)
(2)若A与乙酸相对分子质量相等,则A的结构简式可以是 。(写出1个即可)。
(3)若A中C、H元素质量分数之和为86.67%,其余为O,A的分子量小于200,则A的分子式为 。如果A中含苯环结构且能发生银镜反应,符合条件的A的同分异构体有 (写两个即可)。
21.(10分)科学家预测“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ
C.2H2(g) + O2(g) = 2H2O(l);△H =-571.6kJ
D.H2(g) + 1/2O2(g) = H2O(g);△H = -285.8kJ
 (2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
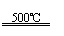
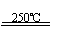 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘。
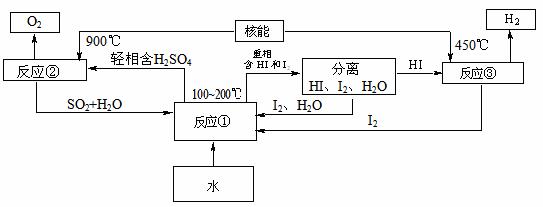
请写出反应①的化学方程式: 。
用硫-碘热循环法制取氢最大的优点是 。
(4)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的两点理由。
20.(10分)已知A-L所代表的物质(溶液中的溶质),除B外均是中学化学里常见的物质,它们的转化关系如图所示。(反应时加入或生成水均略去)
已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②-③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7:5;请填写下列空白:
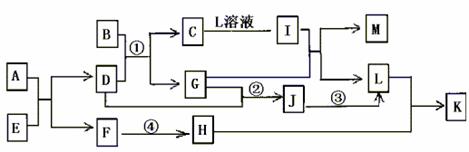
(1)A的电子式 ,B的化学式 。
(2)反应②的工业生产条件 ,写出工业生产L时反应 ①的设备名称 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: ,
②反应④的化学方程式: 。
19.(8分)不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
电负性值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 。
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(4)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:(写出判断的方法和结论) ;请设计一个实验方案证明上述所得到的结论: 。
18.(12分)学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、 、 、 等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、 、 。
(2)实验编号3的实验中KClO3的分解率为___________________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是 (填分子式),可用 试纸检验。上述异常现象产生的原因是 。
VI 实验结论:____________________________________________________________。
17.(10分)现有下列仪器或用品:a.铁架台(含铁圈、铁夹)b.锥形瓶c.滴定管d.烧杯(若干)e.玻璃棒f.胶头滴管g.托盘天平(含砝码) h.滤纸i.量筒j.漏斗 k.温度计
现有下列试剂:A、NaOH固体 B、碳酸钠溶液 C、氯化镁溶液 D、蒸馏水
试填空:
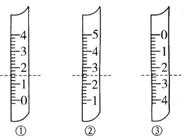 (1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是______________。
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是______________。
A、①是量筒,读数为1.5mL
B、②是量筒,读数为2.5mL
C、③是滴定管,读数为2.50mL
D、②是温度计,读数是2.5℃
(2)配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是______________。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用的试剂是:________(选填序号),操作方法是__________、_________洗涤。完成上述操作,上述仪器或用品用到的有______________________________(从上述仪器或用品中选择,并填上相应序号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com