
题目列表(包括答案和解析)
21.(10分)水体污染问题是目前人们十分关注的环境问题之一,下图是某河流受到城市生活污水(主要含有机物)的轻度污染,以及水体自身净化部分示意图。请回答有关问题:
(1)图中绘出的三种曲线分别代表氮、磷等无机盐总量,水中氧气溶解量(DO),有机物溶解量,其中表示水中DO变化曲线的是 ▲ (选填A、B、C)
(2)目前推广使用无磷洗衣粉,并提倡科学合理施用化肥,其目的是防止水体
▲ (填与环境相关的术语)。
(3)某研究性学习课题小组拟调查测定本地区水质污染情况,如果你是课题小组成员,现要取三份不同地区的水样,你选择的三个地点是:
① ▲ ② ▲ ③ ▲
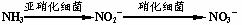 (4)氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下:
。
(4)氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下:
。
某同学在该地工业园区取得水样,准备检测其中无机氮的含量,查阅工具书后,决定先检测水样中的铵或氨的浓度,反应原理为2K2[HgI4]+NH4Cl+4KOH==(OHg2NH2)I(红色)+KCl+7KI+3H2O,用比色法(比较颜色的深浅的测定方法)测定。
①比色法能测定其中NH3-NH4+浓度的大小,其判断的依据是 ▲ 。
②若测得的含量异常偏高,再用其他方法测得NO2-和NO3-含量也偏高。可能的原因是 ▲ 。
A、可能是硝酸工厂大量排出的含硝酸的废水
B、合成氨厂,刚排放的溶有氨的废水
C、造纸厂排出的有机废水和合成氨厂排出的溶有氨的废水
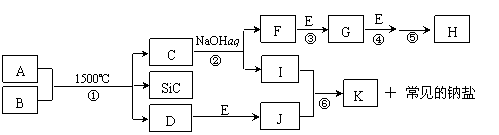
20.(8分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。
回答下列问题:
⑴ 写出下列物质的化学式:F ▲ ,I ▲ ;
⑵ 写出反应③的化学方程式: ▲ ;
⑶ 写出反应⑥的离子方程式: ▲ ;
⑷ B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式: ▲ 。
19.(8分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
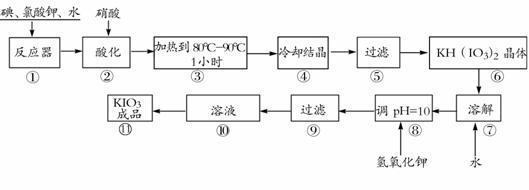
(1)步骤①反应器发生的反应中,转移电子总数为 ▲ ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ▲ ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ▲ ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 ▲ 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
18.(12分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: ▲ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ▲ ,反应的离子方程式为 ▲ 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 ▲ (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
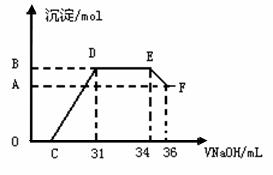
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
 试回答下列问题:
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 ▲ 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ▲ ;上述现象说明溶液中___ ▲ _结合OH-的能力比
▲ 强(填离子符号)。
(3)B与A的差值为 ▲ mol。
(4)B点对应的沉淀的物质的量为 ▲ mol,C点对应的氢氧化钠溶液的体积为 ▲ mL
17.(10分)某兴趣小组同学共同设计了如图所示的实
验装置。该装置既可用于制取气体,又可用于验证物
质的性质。
(1)打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,但装置II只能收集H2、NH3,不能收集O2。其理由是 ▲ 。
(2)乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。
你认为他的改进方法是 ▲ 。
(3)打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。将A中的浓盐酸加入B中一段时间后,观察到C中的现象是 ▲ ;仪器D在该装置中的作用是 ▲ 。
(4)打开K2关闭K1,丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是 ▲ 。
16.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能发生加成反应,乙烷不能发生加成反应
C.甲苯能使酸性高锰酸钾溶液褪色,乙烷、苯不能使酸性高锰酸钾溶液褪色
D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
第Ⅱ卷(非选择题 共64分)
15.相对分子质量为M的气态化合物V L(已换算成标准状况)溶于m g水中,得到溶液的质量分数为ω%,物质的量浓度为c mol/L,密度为ρ g·cm-3,则下列说法正确的是
A.相对分子质量M可表示为: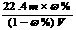
B.物质的量浓度C可表示为:
C.溶液的质量分数ω%可表示为:
D.溶液密度ρ可表示为:
14.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、
Ba2+、CO32-、SO42-,分别取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+一定存在 B.Cl-可能存在
C.100mL溶液中含0.01mol CO32- D. Ba2+一定不存在,Mg2+可能存在
13.氯酸是一种强酸,室温下,浓度超过40%时就会发生分解,反应可表示为:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:
5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为52.5g,则反应方程式可表示
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
12.下列反应的离子方程式书写不正确的是
A.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O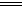 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
B.在Mn2+的溶液中加入HNO3,再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+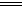 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
C.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32-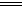 CO2↑+H2O
CO2↑+H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com