
题目列表(包括答案和解析)
2.下列说法中正确的是 ( )
①元素的相对原子质量是该元素原子的质量与一个12C原子质量的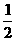 的比值
的比值
②质子数相同的微粒一定属于同一种元素
③分子是保持物质性质的一种微粒
④原子是物质变化中的最小微粒
⑤同一种元素组成的单质是纯净物
A.均不正确 B.②⑤正确 C.③④正确 D.①②正确
1.下列叙述正确的是 ( )
①工业上合成非氧 化物陶瓷氮化硅(Si3N4)需要在高温、空气气氛中进行
②钢铁制品锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳
③建设三峡大坝需要使大量水泥,水泥是硅酸盐材料
④夏天人们佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
31、(10分)已知NaOH与Na2CO3的混合溶液用稀盐酸滴定到酚酞变色时,发生了下列二个反应①NaOH+HCl→NaCl+H2O ②Na2CO3+HCl→NaHCO3+NaCl
(1)25.0mL 0.100mol/L NaOH溶液吸收标准状况下11.2mLCO2,反应后所得溶液的溶质种类及其物质的量?
 (2)取(1)反应后所得溶液10.0mL用0.100mol/L 盐酸滴定至酚酞终点。需该浓度的盐酸多少毫升?
(2)取(1)反应后所得溶液10.0mL用0.100mol/L 盐酸滴定至酚酞终点。需该浓度的盐酸多少毫升?
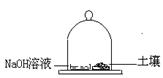 (3)称取25.0g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液,用15.7mL
0.100mol/L盐酸滴定至酚酞终点。同样的实验不放土壤(空白实验)放入盛有同浓度100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液需上述盐酸25.4mL,计算在细菌作用下土壤释放 CO2的速度,以mg CO2/[g(土壤)•h]表示。
(3)称取25.0g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液,用15.7mL
0.100mol/L盐酸滴定至酚酞终点。同样的实验不放土壤(空白实验)放入盛有同浓度100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液需上述盐酸25.4mL,计算在细菌作用下土壤释放 CO2的速度,以mg CO2/[g(土壤)•h]表示。
30、(6分)纳豆(分子中含碳4个以下)是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A。为确定该有机物的结构,现进行如下各实验:①6.00gA在一定条件下完全分解,生成3.36L一氧化碳(标准状况下)和1.80g水;②中和0.240g物质A消耗0.200mol/L NaOH溶液20.0mL
试确定:(1)A的摩尔质量;
(2)A的结构简式.
29、(10分)有机粘合剂是生活和生产中一类重要的材料。粘合过程一般是液态的小分子粘合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α-氰基丙烯酸乙酯(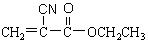 )。在空气中微量水的催化下发生加聚反应,迅速固化而将物品粘牢。请写出“502胶”发生粘合作用的化学方程式:
)。在空气中微量水的催化下发生加聚反应,迅速固化而将物品粘牢。请写出“502胶”发生粘合作用的化学方程式:
。
(2)厌氧胶(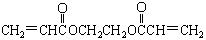 )也是一种粘合剂,在空气中较稳定,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为
)也是一种粘合剂,在空气中较稳定,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为
。
(3)白乳胶是常用的粘合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如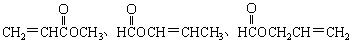 。已知含有
。已知含有 结构的物质不能稳定存在。请另外任写两种含-CH=CH-结构的
结构的物质不能稳定存在。请另外任写两种含-CH=CH-结构的
链状同分异构体的结构简式:
、
。(4)已知醇醛反应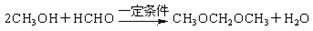 可以发生。聚乙烯醇
可以发生。聚乙烯醇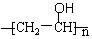 可用做普通胶水,它的羟基可全部与丁醛缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
可用做普通胶水,它的羟基可全部与丁醛缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
。
28、(10分)面临致命性H5N1型禽流感在人群中暴发的危险,目前由瑞士罗氏制药公司生产的口服流感药“达菲”是迄今对禽流感病毒最有效的药物,而莽草酸(C7H10O5)是合成“达菲”(抗禽流感药物)的重要中间体,以下是莽草酸为原料合成有机物B和D的路线:
莽草酸分子结构模型如图:
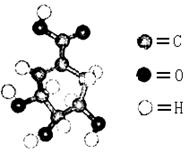
(1)莽草酸结构中含有的官能团的为_________、_________、_________(填名称)。
(2)莽草酸的结构简式为_____________,B的结构简式为_______________。
(3)C→D的化学方程式____________________________________________________。
(4)欲证明莽草酸是一种羧酸,下列实验方案最可靠的是___________(填方案名称),其理由是_____________________________________________________________。
方案甲:取少量莽草酸配成溶液,向溶液中滴加甲基橙看是否变红色。
方案乙:取少量莽草酸配成溶液,向溶液中滴加金属钠看是否有气体产生。
方案丙:向莽草酸中加入一定量的95%乙醇、浓硫酸并加热,看是否能产生油状有香味的物质。
26(A)、(12分)某校学生为探究苯与溴发生反应的原理,改进了课本中该反应的装置(如下图所示,左图为原来课本装置,右图为改进后的装置)。

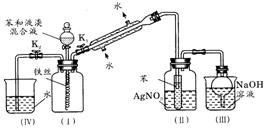
根据相关知识回答下列问题:
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(Ⅱ)中小试管内可能观察到的现象是__________________________;小试管外可能观察到的现象是__________________________________________;小试管中苯的作用是_________________________________。
(2)改进后的装置中能防止倒吸的装置有_________________。(填装置序号)
(3)反应结束后,如何使(Ⅳ)中的水倒吸入(Ⅰ)中?请简述操作过程:
_____________________________________________________________________。
(4)与改进前的装置相比较,改进后的装置能否证明苯和溴发生了取代反应?________(填“能”或“不能”),其理由是:__________________________________________。
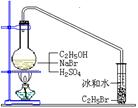 26(B)、(12分)在实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2–3g),适量水,加少量乙醇,再加两倍于乙醇的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热。已知溴乙烷的沸点为38.4℃,其密度比水大,常温下为不溶于水的油状液体。请回答下列问题:
26(B)、(12分)在实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2–3g),适量水,加少量乙醇,再加两倍于乙醇的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热。已知溴乙烷的沸点为38.4℃,其密度比水大,常温下为不溶于水的油状液体。请回答下列问题:
(1)现有98%的浓硫酸、蒸馏水、100mL烧杯、20mL量筒、玻璃棒等,写出配制20mL 1:1浓硫酸的操作过程:_________________________________________________________________________
_________________________________________________________________________。
(2)此反应中使用1:1的浓硫酸,与使用98%的浓硫酸相比其优点有(写二条):
①______________________________;②_________________________________。
(3)写出该方法制备C2H5Br的化学方程式:
__________________________________________________________________________。
(4)使用98%浓硫酸,发生副反应的化学方程式为________________________________。
(5)溴乙烷用冰水混合物收集的依据是_______________________________________
__________________________________________________________________________。
27、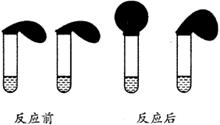 (12分)某教材中有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(12分)某教材中有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义): HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) +Q1; Q1<0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) +Q2; Q2 >0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高 或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
A、NaHCO3的溶解是吸热过程 B、NaHCO3的饱和溶液和盐酸的反应是吸热反应
C、Na2CO3的溶解是放热过程 D、Na2CO3的饱和溶液和盐酸的反应是吸热反应
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________
____________________________________________________。
25、(8分)在一定条件下,反应N2(g) +3H2(g)  2NH3(g)达到平衡:
2NH3(g)达到平衡:
(1)该反应的平衡常数表达式为_______________________;
(2)其它条件不变,减小压强平衡向________反应方向移动(填“正”或“逆”);
(3)可以判断此反应达到化学平衡状态的是____________(填字母编号);
A.等温等容下体系的压强不变 B.等温等容混合气体的密度不变
C.混合气体平均相对分子质量不变 D.等温等压下混合气体的体积不变
(4)当温度与压强不变时,增大N2的物质的量,则逆反应速率_______(填“变大”“变小”或“不变”)。平衡常数________(填“变大”“变小”或“不变”)。
|
族
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
一 |
① |
|
|||||
|
二 |
② |
③ |
④ |
⑤ |
|
⑥ |
|
|
三 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑨的氢化物的化学式为 ,此氢化物的还原性比元素⑥的氢化物的还原性 (填“强”或“弱”)。
(2)表中某元素原子的最外层p电子数比s电子数少1,则该元素的元素符号是 。
(3)表中给出元素单质可以形成原子晶体的是 (填序号)。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的离子方程式:
。
23(B)、(8分)下表是元素周期表的一部分,表中所列字母分别代表一种化学元素:
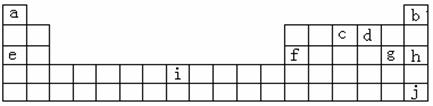
(1)b、h、j的单质熔点由高到低的顺序_____________(填字母)。
(2)以上元素形成的金属单质中,熔点最低的是_________(填元素符号)。
(3)f元素单质是在生活、生产中用量很大的金属之一,试写出工业上制备f元素单质的化学方程式_________________________________________________。
(4)c元素的单质用途_____________________________________________、________________________________________(填二条)。
24、(8分)含氮废水进入水体对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:
____NO3-+ ____Al+ ____H2O → ____N2↑+ ____Al(OH)3↓+ ____OH-
(2)上述反应中,还原剂是_________,被还原的元素是_________,每生成2mol N2,将有_________ mol电子发生转移。
(3)有上述废水100m3,若要完全消除污染,则所消耗金属铝的质量为_________g。
22、常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
A.酸性由强至弱:HX>HY>H2CO3
B.结合H+的能力:Y―>CO32―>X―>HCO3―
C.溶液物质的量浓度相同时碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:
c(X―)>c(Na+)>c(HCO3―)>c(OH―)
 高三年级质量监控
高三年级质量监控
化学试卷
 第Ⅱ卷(共84分)
第Ⅱ卷(共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com