
题目列表(包括答案和解析)
5.某无色溶液中,若加入NaClO溶液或适量HCl溶液,均能产生淡黄色沉淀。则该溶液中可能大量存在的离子组是:
A.Na+、K+、S2-、Cl- B.H+、Na+、S2-、NO3-
C.K+、Ca2+、S2-、SO32- D.Na+、S2-、SO32-、SO42-
4.下列实验设计能够成功的是:
|
|
实验目的 |
实验步骤及现象 |
|||
|
A |
检验亚硫酸钠试样是否变质 |
 |
|||
|
B |
检验某卤代烃是否是氯代烃 |
 |
|||
|
C |
证明酸性条件下H2O2氧化性比I2强 |
 |
|||
|
D |
除去氯化钠溶液中的少量硫酸钠 |
溶液 |
3.下列说法正确的是:
A.化学式符合XOH(X代表某一元素)的物质一定是碱
B.分子式为C6H6的物质一定是苯
C.最简单的烯烃一定是乙烯
D.含碳量最高的烃一定是乙炔
2.《新科学家》网站报道,科学家通过电解Fe2O3-SiO2-CaO的熔融液(1600℃)制得了铁和氧气。与常规方法比,将该方法用于工业上大规模冶铁,以下优点分析错误的是:
A.副产物可做工业用氧 B.大幅度降低能耗
C.大幅度降低温室气体的排放 D.制得更纯的铁
1.新华社2007年3月21日电,全国科学技术名词审定委员会21日公布:111号元素(符号为Rg)的中文名称为“ ”(读音为伦)。下列说法正确的是:
”(读音为伦)。下列说法正确的是:
A.111号元素是第6周期、第ⅠA族的金属元素 B.111号元素属于过渡元素
C.111号元素为非金属元素 D.111号元素质量数为111
24.B(8分)有机化合物A的分子式是C13H20O8(相对分子质量为304),1mol A在酸性条件下解得到4mol CH3COOH和1molB。B分子结构中每一个连有羟基的碳原子上还连有两个氢原子。
请回答下列问题:
(1)A和B的相对分子质量之差是 。
(2)B的结构简式是 。
(3)B能发生的反应是 (填写序号)。
①氧化反应 ②取代反应 ③消去反应 ④缩聚反应
(4)已知:

以两种一元醛(其物质的量之比为1:4)和必要的无机试剂为原料合成B,写出合成B的各步反应的化学方程式。
24.A(8分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能/kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
(1)Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是 。
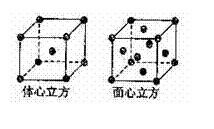 (3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 晶体。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 晶体。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 。
23. (10分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
(10分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
催化剂:铁触媒,温度400℃~500℃,压强:30MPa~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30MPa~50MPa的原因是
;从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400℃~500℃的高温,原因是
。
(2)500℃、50MPa时,在容积为1L的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
(3)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式
。
24题为选做试题,考生可从A、B两小题中任选一题进行解答,若两题均做,则以A题为准。
21.(8分)已知A、B、C、D四种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的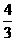 倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
请回答下列问题:
(1)B、D两元素的名称分别是 、 。
(2)Y与C的最高正价氧化物的水化物恰好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),其原因是(用离子方程式表示) 。
(3)在(2)所得生成物的水溶液中,存在着如下关系,请用粒子浓度符号填写:
①c(H+)+ =c(OH-)+ ;
②c(NH )+c(NH3·H2O)+c(NH3)=
。
)+c(NH3·H2O)+c(NH3)=
。
 22.(10分)下图所示各物质间的转化关系中,A、B是两种钠盐,均含有同一种非金属元素。
22.(10分)下图所示各物质间的转化关系中,A、B是两种钠盐,均含有同一种非金属元素。
请根据图示关系,回答下列问题:
(1)写出下列物质的化学式:沉淀③ ,溶液⑨(溶质) 。
(2)写出下列反应的离子方程式:
②→⑥ 。
⑦→④ 。
(3)混合溶液①中的两溶质A和B可能存在多种组合,将其可能的组合中A和B的化学式及其物质的量nA、nB间应满足的数学关系式填入下表中(任填二种)
|
组合 |
A |
B |
nA和nB的关系 |
|
I |
|
|
|
|
II |
|
|
|
20.(10分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应。但稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为 。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜溶于稀盐酸。请在下列方框中画出该装图
(2)在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积 (填写“大于”、“等于”、或“小于”)lOOmL。若欲使剩余的铜片继续溶解,可在其中加入硝酸盐,则该反应的离子方程式为 。
(3)将等两份质量的铜片分别与等体积过量的浓硝酸和、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗? (填“同意”或“不同意”),原因是 。另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com