
题目列表(包括答案和解析)
7.若200mLc(H+)=1×10-3mol·L-1的某一元酸和100mL
c(OH-)=1×10-3mol·L-1的某一元碱溶液相混合后,溶液呈碱性。所用的酸和碱应是 ( )
A.等浓度的弱酸和强碱 B.稀的强酸和稀的强碱
C.稀的弱酸和浓的强碱 D.稀的强酸和浓的弱碱
6.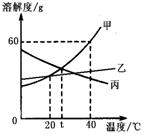 甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
A.40℃时,100g水中最多溶解甲60g
B.t℃时,甲与丙的溶解度相等
C.分别将40℃时甲、丙的饱和溶液降温至t℃,
所得两溶液中溶质的质量分数相等
D.甲中混有少量乙,可用降温结晶法分离提纯甲
5.在反应容器中充入lmolA气体和nmolB气体,在一定条件下发生反应:A(g)+nB(g)  mD (g),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的
mD (g),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的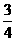 ,则n和m的数值可能是
( )
,则n和m的数值可能是
( )
A.n=l m=l B.n=2 m=2 C.n=3 m=3 D.n=2 m=3
4.下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l);△H=十57.4 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s);△H > 0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g)△H=-483.6 kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D.已知2C(S)+2O2(g)=2CO2(g); △H1 2C(s)+O2(g)=2CO(g) △H2 则△H1<△H2
3.等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是 ( ) A.[M+]>[OH-]>[A-]>[H+] B.[M+]>[A-]>[H+]>[OH-] C.[M+]>[A-]>[OH-]>[H+] D.[M+]>[H+] =[OH-]+[A-]
2.下列各组物质的分类正确的是 ( )
 A.强碱:NaOH、RbOH、Ba(OH)2
B.非电解质:SO2、氨水、C2H5OH
A.强碱:NaOH、RbOH、Ba(OH)2
B.非电解质:SO2、氨水、C2H5OH
C.碱性氧化物:MgO、Mn2O7、Na2O2 D.同系物:
1.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是 ( )
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
22.(10分)(1)在硫酸的工业生产中,最后的产品是质量分数为98%的硫酸或20%的发烟硫酸(H2SO4和SO3的混合物,其中含20%的SO3)。若98%的硫酸可表示为SO3•aH2O,20%的发烟硫酸可表示为H2O•bSO3,则a、b的值(a、b可用分数表示)分别是:
a b .
(2)使一定质量的锌与100 mL18.5 mol/L浓硫酸充分反应,锌完全溶解,同时生成标准状况下的气体A33.6L。将反应后的溶液稀释至1L,测得溶液PH=1。气体A中含有的气体为 ,其组成的体积比为 。
(3)FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体为ρg/cm,晶胞边长为a cm。求: FexO中x值为 。
21.(11分)已知A-L所代表的物质(溶液中的溶质),除B外均是中学化学里常见的物质,它们的转化关系如图所示。(反应时加入或生成水均略去)
已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②-③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7:5;请填写下列空白:
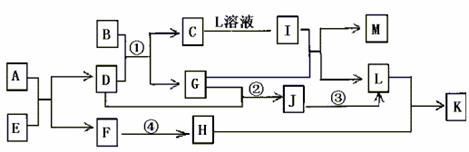
(1)A的电子式 ,B的化学式 。
(2)反应②的工业生产条件 ,写出工业生产L时反应①的设备名称 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: ,
②反应④的化学方程式: 。
20.(3分)近年来,由于共生工程的应用,利用发电厂产生的SO2,可以制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。
(1)写出电极反应:负极反应为 ;正极反应为 。
(2)这种方法处理发电厂废气中SO2的优点是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com