
题目列表(包括答案和解析)
5.下列说法正确的是 ( )
A.摩尔是6.02×1023个结构微粒的集体
B.0.012kg12C所含的原子数精确值是6.02×1023
C.1mol H就是1mol氢 D.1molH2SO4的质量是98g
4.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是 ( )
A.100g98%的浓硫酸中含氧原子个数为4×6.02×1023
B.5.6 g铁粉与硝酸反应失去的电子数一定为3×6.02×1022
C.标准状况下,22.4LCH4和CH3Cl的混合物所含有的分子数目约为6.02×1023
D.6.2g氧化钠和7.8g过氧化钠的混合物中所含有的离子总数约为7×6.02×1022
3.100g质量分数为3.65%的盐酸与11.6gNa2CO3·xH2O刚好完全反应,则x值是( )
A.1 B.3 C.7 D.9
2.用固体NaOH配制物质的量浓度溶液时,下列操作导致溶液浓度偏高的是 ( )
A.在烧杯中溶解时,有少量液体溅出 B.样品中混有Na2O杂质
C.容量瓶使用前未经干燥 D.定容时眼睛在容量瓶刻度线下方
1.2007年6月,“八国峰会”再次就温室气体减排问题展开磋商并初步达成共识。为减少二氧化碳这种温室气体的排放,下列措施不切实际的是 ( )
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
28(10)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大。A是非金属性最强的元素且A、D同主族;B、C、D同周期, B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水;E是第四周期主族元素。试回答:
(1)写出E原子的核外电子排布式
(2)A和D氢化物中,沸点较高的是 (填化学式);A、B、C、D的离子中,半径由大到小的顺序是 (填写离子符号)。
(3)元素C在元素周期表中的位置是第 周期, 族。元素C和D形成的化合物的晶体类型为 ,该化合物易形成二聚分子,其结构式为 ,C与D之间的成键方式为 ,中心C原子采用 杂化。
(4)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点和面心;阴离子均位于小正方体中心。该化合物是 (填写化学式)。
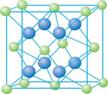
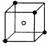
晶胞 晶胞的1/8
26(10分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式
__________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_________________________________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________(填化学式)
27(10分)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
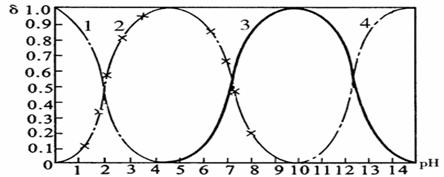
1表示H3PO4;2表示H2PO4-;3表示HPO42-;4表示PO43-
(1)设磷酸总浓度为c(总),写出c(总)与各含磷粒子浓度间的关系式
。
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是 。
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是
。
(4)在Na3PO4溶液中,c(Na+)/ c(PO43-) 3(填“>”、“=”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/ c(PO43-)的值减小,原因是 。
24(8分)工业上可利用反应:CH4(g)+H2O(g) CO(g)+3H2(g) ,生产合成氨原料气H2。
CO(g)+3H2(g) ,生产合成氨原料气H2。
已知温度、压强和水碳比[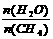 ]对甲烷蒸气转化反应的影响如下图:
]对甲烷蒸气转化反应的影响如下图:
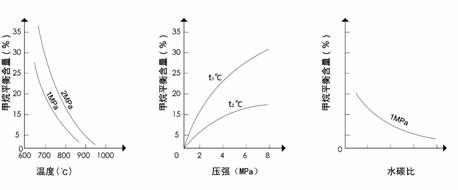
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
该反应平衡常数表达式为K=__________
(1)升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同)。
(2)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(3)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是__________
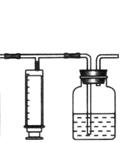
25(13分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高允许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):
⑴ 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,
化学反应离子方程式为: 4MnO4-+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4-+
 5H2C2O4
+ 6H+ == 2Mn2++10CO2↑+ 8H2O
5H2C2O4
+ 6H+ == 2Mn2++10CO2↑+ 8H2O
|
|
|
|
⑶ 实验步骤:
① 检查装置气密性(气密性良好)。
② 用 (填仪器名称)准确移取25.00 mL 1.00×10-3mol·L-1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L-1H2SO4溶液备用。
③ 将2.00×10-3mol·L-1的草酸标准溶液置于 (填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?
_________________________________________________________;
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2-3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将 (填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)。 。
⑦ 再重复实验2次。
⑷ 数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 25.00mL):
|
装修后 第n天 |
草酸溶液(mL) |
甲醛的浓度 mg/m3 |
|||
|
1 |
2 |
3 |
平均值 |
||
|
1 |
15.86 |
15.72 |
15.67 |
15.75 |
|
|
7 |
26.17 |
26.36 |
26.38 |
26.27 |
|
|
30 |
30.90 |
30.67 |
30.81 |
30.79 |
|
设KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为V1(mL);
草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为V2(mL)
则:计算室内空气中甲醛浓度(mg/m3)的代数式为 ,计算第30天室内空气中甲醛浓度为_____________(精确到小数点后二位),并判断此时主人________(填“能”或“否”)入住。
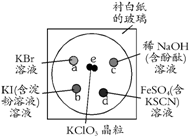 21(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
21(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,(1)试描述反应的现象,(2)写出e、d处相应的化学反应方程式,a、b、c处相应的离子反应方程式。
e处:现象
化学反应方程式
a处:现象
离子反应方程式
b处:现象
离子反应方程式
c处:现象
离子反应方程式
d处:现象
化学反应方程式
22(9分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 。写出H2O2在二氧化锰作用下发生反应的化学方程式 。
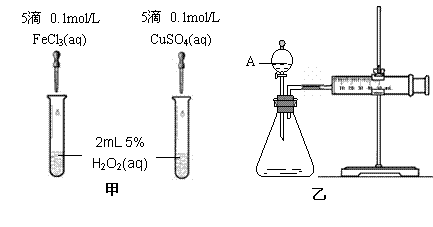
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
23(10分)
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度________________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为___________________________________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H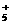 +H2O N2H4+H2O
+H2O N2H4+H2O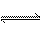 N2H
N2H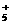 +OH-
+OH-
N2H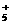 +H2O
+H2O N2H
N2H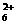 +OH- N2H
+OH- N2H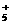 + H2O
+ H2O N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO ==_________NaCl+_______N2H4+_____ _____
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式
______________________。
20.常温下,下列各溶液的叙述中正确的是( )
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
第II卷 非选择题(共80分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com