
题目列表(包括答案和解析)
18、M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心,在战争中保住了很多士兵的生命。M5纤维是线形结构且又有分子间氢键的聚合物,在三维方向x、y、z上,当方向z是聚合物主链方向时,在x方向和y方向上的氢键是其晶体结构的特征。下面是M5纤维的合成路线(部分反应未注明条件):
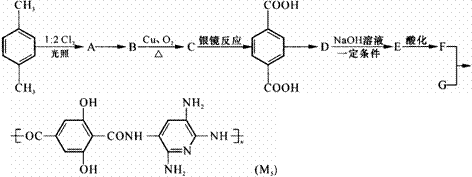
请回答:
⑴写出合成M5的单体的结构简式:F ,G ;
⑵写出反应类型:A→B ,B→C ;
⑶生成A的同时可能生成的A的同分异构体是 ;
⑷写出化学方程式:C→对苯二甲酸 ;
D→E ;
⑸1 molF与NaHCO3溶液反应,最多消耗NaHCO3 mol;
⑹M5纤维分子间为什么会有氢键?请分析说明: 。
17、(10分)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
⑴配制实验用的溶液。要配制200 mL密度为1.2 g·cm-3的溶质质量分数为16% 的NaOH溶液,需要称取 gNaOH固体。
⑵把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,
取出用水冲洗。写出除去氧化膜的离子方程式: 。
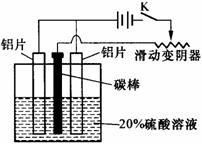 ⑶如右图,组装好仪器,接通开关K,通电约25 min。
在阳极生成氧化铝,阴极产生气体。写出该过程中
的电极反应式:
⑶如右图,组装好仪器,接通开关K,通电约25 min。
在阳极生成氧化铝,阴极产生气体。写出该过程中
的电极反应式:
阳极: ;
阴极: ;
⑷断开电路,取出铝片,用1%稀氨水中和表面的酸 液,再用水冲洗干净。写出该过程发生反应的离子 方程式: 。
16、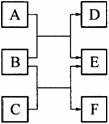 (8分)A、B、C、D、E、F是六种中学化学中常见的物质,皆由短周期元素组成,有如下转化关系:
(8分)A、B、C、D、E、F是六种中学化学中常见的物质,皆由短周期元素组成,有如下转化关系:
⑴若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒 气体。B、D、F皆为非金属单质,且D为气体。则A的结构式
为 ,1 molC中含有 个共价键。
⑵若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对 分子质量最小;D、E、F皆为氧化物,其中D、F为有毒气体。则
①A、C、E沸点由高到低的顺序为 (填化学式)。
②A与D在常温下反应可生成一种单质,化学方程式为 。
15、(12分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
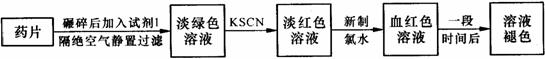
⑴试剂1是 ,加入新制氯水后溶液中发生反应的离子方程式是 ;
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的
原因是 ;
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色
的原因,甲、乙、丙三位同学首先进行了猜想:
|
编号 |
猜 想 |
|
甲 |
溶液中的+3价Fe又被还原为+2价Fe |
|
乙 |
溶液中的SCN-被过量的氯水氧化 |
|
丙 |
新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的
实验操作、预期现象和结论。(不一定填满,也可以补充)
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
|
|
|
|
|
|
|
14、已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
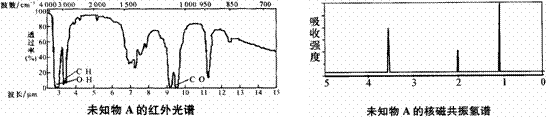
A、由红外光谱可知,该有机物中至少含有三种不同的化学键
B、由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为l:2:3
C、由其核磁共振氢谱可推知其分子中的氢原子总数
D、若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
第Ⅱ卷 (非选择题共72分)
13、氧化还原反应广泛应用于金属的冶炼。下列说法中,错误的是
A、冶炼铁的主要原料有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿石中的脉石(二氧化硅)
B、湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C、用磁铁矿炼铁的反应中,1 molFe3O4被CO还原成Fe,转移9 mol e-
D、铝热法还原铁的反应中,放出的热量能使铁熔化
12、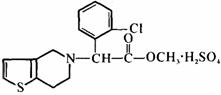 波立维是国家刚刚引进的新药,它给中风、心
肌梗死等心脏病患者带来福音。波立维属于硫酸
氢盐,它的结构如右图所示。下列关于它的说法
中,正确的是
波立维是国家刚刚引进的新药,它给中风、心
肌梗死等心脏病患者带来福音。波立维属于硫酸
氢盐,它的结构如右图所示。下列关于它的说法
中,正确的是
A、该物质的化学式为C16H15ClNO2·H2SO4
B、该物质难溶于水
C、波立维能形成硫酸氢盐是与其结构中的氮原子有关
D、它可以与NaOH溶液反应,1 mol该物质最多可消耗2 molNaOH
11、常温下,下列各溶液的叙述中,正确的是
A、0.1 mol/L醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:
c(Ac-)>c(Cl-)>c(H+)>c(HAc)
B、pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)
C、0.1 mol/L醋酸的pH=a,0.01 mol/L醋酸的pH=b,则a+1>b
D、已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)]
10、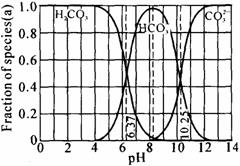 右图是一水溶液在pH从0至14的范围内,
H2CO3、HCO3-、CO32-三种成分平衡时的组成
百分率,下列叙述中,正确的是
右图是一水溶液在pH从0至14的范围内,
H2CO3、HCO3-、CO32-三种成分平衡时的组成
百分率,下列叙述中,正确的是
A、此图可完全根据1.0 mol/L盐酸滴定 1.0 mol/L碳酸钠溶液的实验数据绘出
B、1.0 mol/L盐酸滴定1.0 mol/L碳酸钠溶液 恰好反应时呈中性
C、二氧化碳溶液在血液中多以HCO3-的形式存在
D、在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
9、在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
I、将3 molA和2 molB在一定条件下反应,达平衡时C的体积分数为a。
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法中,正确的是
①若I达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
②若向I平衡体系中再加入3 molA和2 molB,C的体积分数若大于a,可断定
x>4
③若x=2,则Ⅱ体系起始物质的量应当满足3n(B)=n(A)+3
④若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B)时,可断定x=4
A、①② B、①④ C、②③ D、③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com