
题目列表(包括答案和解析)
5.Na2O、HCl、Al2O3三种物质在水中完全反应后,溶液呈中性,则参加反应的Na2O、HCl、Al2O3物质量之比可能为( )
 A.3:2:1 B.2:4:1 C.2:3:1 D.4:2:1
A.3:2:1 B.2:4:1 C.2:3:1 D.4:2:1
4.已知:在10mL盐酸、氯化铝和氯化铁的混合溶液中,各阳离子的物质的量浓度相等,氯离子的物质的量浓度为7mol·L-1,向此溶液中加入1mol·L-1的NaOH溶液,至沉淀质量不再变化,此时所需NaOH溶液的体积为( )
A.70mL B.80mL C.50mL D.40mL
3.“神舟五号”载人飞船成功升空和回收备受世界瞩目。其运载火箭“长征二号”使用偏二甲肼(C2H8N2)和四氧化二氮为推进剂,发生反应后生成N2,CO2 和H2O。该反
应配平后N2的化学计量数为( )
A.1 B.2 C.3 D.4
2.铁溶于一定浓度的硝酸时,反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hNO2↑+kH2O 下列有关推断中,不正确的是( )
A.反应中每消耗5.6 g Fe,转移(2d+3f)/amol e - B.当a不变时,f随着b的增大而增大
C.HNO3的氧化性大于Fe3+ D.c-b = 3g+h
1.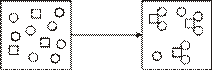 物质X(□)和物质Y(〇)的反应中微粒之间的关系如图34-1所示,对该反应的描述,下列反应方程式正确的是(
)
物质X(□)和物质Y(〇)的反应中微粒之间的关系如图34-1所示,对该反应的描述,下列反应方程式正确的是(
)
A.3X+8Y→X3Y8
B.3X+8Y→3XY2+2Y
|
D.X+2Y→XY2
34.有关化学方程式的计算
12.在NO3-离子浓度为4mol·L-1硝酸铜和硝酸银的混合液100mL中加入定量的铝粉,充分反应后,过滤,将滤纸上的沉淀干燥后称重为24.8g,将沉淀物置于盐酸中无气体放出。向滤液中滴入氯化钡溶液无现象,后加入过量氢氧化钠溶液得到沉淀,过滤后,将沉淀加热、干燥得黑色化合物4g。
(1)写出反应中的离子方程式:_______________________________________________。
(2)求参加反应的铝的质量。
9.下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其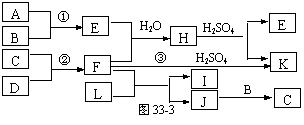 相对分子质量为32。
相对分子质量为32。
请按要求填空:
(1)反应③的化学方程式 。
(2)C的结构式 ;H的化学式 。
(3)L的溶液与化合物E反应的离子方程式 。
(4)化合物J的化学式 。
|
 10.常温下,浓HNO3与Cu反应后形成Cu(NO3)2溶液,Cu2+ 以[Cu(H2O)4]2+的形式存在,呈蓝色;而反应中产生的 NO2溶解在 HNO3 中而使溶液呈黄色,黄色与蓝色的混合色即为绿色。现将该绿色溶液分成两份,进行以下实验:
(1)取一份溶液充分加热,产生出大量红棕色气体,溶液变为蓝色,这是因为
(2)另取一份溶液加水,溶液变为蓝色,这是因为
。
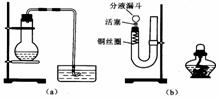
11.在研究性学习中,用稀HNO3与Cu反应来制备NO气体。有两位学生设计了如图33-4所示两个实验装置(a)和(b)。回答有关问题:
10.常温下,浓HNO3与Cu反应后形成Cu(NO3)2溶液,Cu2+ 以[Cu(H2O)4]2+的形式存在,呈蓝色;而反应中产生的 NO2溶解在 HNO3 中而使溶液呈黄色,黄色与蓝色的混合色即为绿色。现将该绿色溶液分成两份,进行以下实验:
(1)取一份溶液充分加热,产生出大量红棕色气体,溶液变为蓝色,这是因为
(2)另取一份溶液加水,溶液变为蓝色,这是因为
。
11.在研究性学习中,用稀HNO3与Cu反应来制备NO气体。有两位学生设计了如图33-4所示两个实验装置(a)和(b)。回答有关问题:
(1)写出铜与稀硝酸反应的化学方程式:_______________________。
(2)如果采用(a)装置,若加入20mL 6mol·L-1HNO3和2g薄铜片,在反应开始时,可观察到水槽内的导管中水面先慢慢上升到一定高度,此后又回落,然后有气泡从导管口冒出。
试说明产生上述现象的原因:____________________________________________________。
(3)如果采用(b)装置,请将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到________为止。
②关闭活塞,用酒精灯在________微热,当反应发生时,立即撤去酒精灯。
③反应在什么情况下可以自动停止?可以在何处观察到无色的NO气体?
__________________________________________________________________________。
④如果再将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?
__________________________________________________________________________。
⑤如果需再获得NO与已生成的NO2鲜明对照的实验效果,应________(填操作)。
3.某稀硝酸能与5.4g铝恰好反应,当这份酸在与铁反应时,最多消耗铁的量为( )
A. 16.8g B. 0.4mol C. 11.2g D. 0.2mol
4已知:2NO2+H2O(冰水)→HNO3+HNO2,结合已有知识推断,下列结论正确的是( )
A.HNO2比HNO3更不稳定 B.HNO2的分解产物是NO和H2O
C.HNO2的分解产物是NO2和水 D.NO2既是HNO3的酸酐,也是HNO2的酸酐
5某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属不会溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
6足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
7某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图33-1所示,对图中曲线的描述正确的是( )
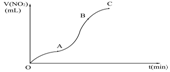 A.OA段表示开始时,反应缓慢,主要由于生成的是NO
A.OA段表示开始时,反应缓慢,主要由于生成的是NO
B.AB段表示反应速率较快,可能因为产物有催化作用
|
D.OC线表示随时间增加,反应速率逐渐增大
8下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有图33-2转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
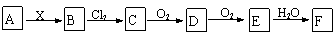
|
下列说法中不正确的是( )
A.X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.和Cl2的反应是氧化还原反应
D.X是强酸时,C在常温下是气态单质
2. 丹麦物理学家玻尔将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”:Au + HNO3 +3HCl=AuCl3
+NO +2H2O,AuCl3 +HCl =
HAuCl4 (四氯合金酸),纳粹分子对这种溶液毫无所知。战争结束后,玻尔又根据以下反应,炼出黄金并铸出更加灿烂夺目得奖章:2HAuCl4
2HCl↑+Cl2↑+Au,表现出科学家对祖国的无比热爱和非凡智慧。玻尔的以上操作中应用的化学原理正确的是( )
丹麦物理学家玻尔将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”:Au + HNO3 +3HCl=AuCl3
+NO +2H2O,AuCl3 +HCl =
HAuCl4 (四氯合金酸),纳粹分子对这种溶液毫无所知。战争结束后,玻尔又根据以下反应,炼出黄金并铸出更加灿烂夺目得奖章:2HAuCl4
2HCl↑+Cl2↑+Au,表现出科学家对祖国的无比热爱和非凡智慧。玻尔的以上操作中应用的化学原理正确的是( )
A.盐酸有很强的还原性 B.金离子(在配离子[AuCl4]-中)有很强的还原性
C.王水有很强的氧化性 D.氯气是上述反应中的氧化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com