
题目列表(包括答案和解析)
8、用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
7、下列文字表述与反应方程式对应且正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯: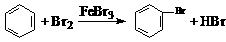
6、化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
5、某白色固体可能由①NH4Cl②AlCl3③NaCl④AgNO3⑤KOH中的一种或几种组成,将此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色。若向该溶液中加入稀硝酸至过量,有白色沉淀生成。对原固体组成的判断不正确的是 A.可能存在② B.至少有②⑤ C.无法确定是否有③ D.至少存在①④⑤
4、有以下七种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③Na2SiO3 ④CaCl2 ⑤Na2CO3 ⑥NaAlO2 ⑦NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是 A.③④⑥ B.①③⑥ C.③⑤⑥⑦ D.③⑥
3、某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下实验现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断,该溶液中肯定不存在的离子是 A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I- C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
2、20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
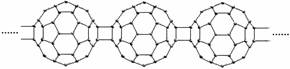
A.X难溶于水 B.一定条件下X可与H2发生加成反应
C.X是碳的一种同素异形体 D.X的摩尔质量为720n
1、每个人都应懂得防火知识,并学会火灾时如何逃走。例如,当高层楼房下层起火,火势凶猛无法扑灭时,下列逃生措施中正确的是
①沿楼梯迅速下楼; ②用湿毛巾堵住口鼻;
③匍匐前进,寻找安全出口; ④封闭房门;
⑤迅速转移到阳台,用绳索下坠; ⑥跳楼。
A、①②③④ B、③④⑤⑥ C、①②④⑤ D、②③④⑤
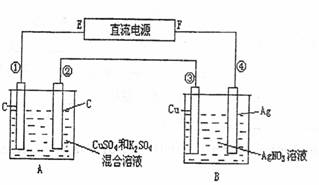 27.(4分)如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池原混合溶液中Cu2+的浓度。
27.(4分)如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池原混合溶液中Cu2+的浓度。
28.(9分)用KMnO4晶体和浓盐酸制取氧气和氯气。取0.2molKMnO4晶体先加热制得一定量的氧气后停止加热,再将残留物与过量浓盐酸混合、加热,得到Cl2,此时溶液中的主要离子是K+、Mn2+、H+、Cl-。计算:
(1)KMnO4晶体完全分解时制得的氧气在标准状况下的体积。
(2)将(1)中完全分解的固体产物与过量的浓盐酸反应,可制得Cl2的物质的量。
(3)若最后得到的Cl2为0.48mol,则KMnO4制氧气时的分解率。
26.(7分)在测定硫酸铜晶体中结晶水的含量的实验操作中:
(1)加热前晶体应该放在 中研碎,加热时是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失水的方法是 。
(3)做此实验时,最少应该进行称量操作 次。
(4)下面是某学生一次实验的数据,请完成计算,填入下面的表中。
|
坩埚质量 |
坩埚与晶体的总质量 |
加热后坩埚与固体的总质量 |
测得晶体中结晶水个数 |
|
11.7g |
22.7g |
18.6g |
|
(5)这次实验中产生误差的原因可能是 (填选项)
A.硫酸铜晶体中含有不挥发的杂质B.实验前晶体表面有水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com