
题目列表(包括答案和解析)
18、高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
|
酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是:
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
第II卷(共87分)
17、二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,
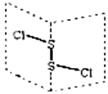 S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
A.S2Cl2的结构式为Cl-S-S-Cl
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
16、下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。下列叙述中不正确的是
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。下列叙述中不正确的是

A.甲组操作时,溶液颜色变深 B甲组操作时,微安表(G)指针发生偏转
C.乙组操作时,C2做正极 D乙组操作时,C1上发生的电极反应为I2 +2e-=2I--
15、某无色溶液中可能含有Na+、K+、Fe3+、Cu2+、SO 、SO
、SO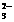 、CO
、CO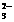 、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7;②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成;③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液;④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤;⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7;②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成;③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液;④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤;⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
A.肯定不存在的离子是Fe3+、Cu2+、SO 、CO
、CO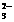
B.肯定存在的离子是Na+、K+、SO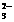 、Br-
、Br-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
14、可逆反应2SO2(g)+O2(g) 2SO3(g)
△H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
2SO3(g)
△H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
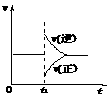 A.维持温度、反应体系体积不变,t1时充入SO3(g)
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
13、
 三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 3HNCO ;8HNCO+6NO2 7N2+8CO2+4H2O 下列说法正确的是
A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 mol NO2在反应中转移的电子为4mol D.反应中CO2是氧化产物
12、下列反应的离子方程式书写正确的是
A.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
C.金属钠溶于足量水中:2Na+2H2O=2Na++H2↑+2OH-
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
11、下述实验能达到预期实验目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将10g CuSO4·5H2O溶解在90g 水中 |
配制质量分数为10%的CuSO4溶液 |
|
B |
向盛有1 mL硝酸银溶液的试管中滴加KI溶液,至不再有沉淀生成,再向其中滴加NaCl溶液 |
说明一种沉淀能转化为溶解度更小的沉淀 |
|
C |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
|
D |
室温下,用pH计测定浓度为0.1mol·L-1NaClO溶液和CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
10、设NA代表阿伏加德罗常数。下列说法正确的是
A.标准状况下,2.24 L NH3气体溶于l L水中得到0.1 mol/L的氨水
B.质子总数为10 NA的重水(D2O)的质量为18g
C.0.4 mol乙炔和乙醛混合气体,在氧气中充分燃烧,消耗氧气的分子数为NA
D.500 mL 0.2 mol/L的K2S溶液中含有的离子总数为0.3 NA
9、反应速率V和反应物浓度的关系是用实验的方法测定的,化学反应:H2+Cl2=2HCl的反应速率V可以表示为:v=k[c(H2)]m• [c(Cl2)]n。式中的k为常数,m和n的值以可用下列表中数据确定之。
|
c(H2)(mol/L) |
c(Cl2)(mol/L) |
V(mol/L·S) |
|
1.0 |
1.0 |
1.0k |
|
2.0 |
1.0 |
2.0k |
|
2.0 |
4.0 |
4.0k |
由此可以推得,m和n的值正确的是
A.m=1 n=2 B.m=1/2 n=1/2 C.m=1 n=1/2 D.m=1 n=1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com