
题目列表(包括答案和解析)
22. (9分) 2007年诺贝尔化学奖授予德国科学家哈德·埃特尔,以表彰他在表面化学研究领域做出的开拓性贡献。表面化学领域的研究可以帮助我们了解众多纷杂的化学过程,如钢铁为何会生锈,燃料电池如何作用以及某些反应的催化剂是如何发挥其功能的,甚至可以解释臭氧层的消耗等。
(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。

若控制其他实验条件均相同,在催化反应器中装有不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积和浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
(2)在汽车的排气管上安装“催化转换器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可能与大气环境中循环的无毒气体,并促使烃类物质充分燃烧。
①写出CO 和NO反应的化学方程式: ,该反应中作氧化剂的物质是 。
②用CH4催化还原NOx也可消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g);△H1== -574kJ/mol
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g);△H2==
若1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2== 。
(3)①有人认为:该项研究可能使氨的合成反应在铁催化剂表面进行时效率大大提高,从而使原料利用率大大提高。请你应用化学基本理论对此观点进行评价:
。
②合成氨工业生产中所用的α-Fe催化剂的主要成份是FeO 、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1︰2时,其催化活性最大,以Fe2O3为原料制备上述催化剂,可向其中加入适量的炭粉,发生反应如下:
2Fe2O3 +C=== 4 FeO + CO2
为制得这种活性最大的催化剂,应向480g Fe2O3粉末中加入炭粉的质量是 。
19(13分).某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置。

A B C D E F
|
|
Ⅰ |
Ⅱ |
Ⅲ |
|
备选装置 |
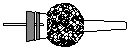 |
 |
 |
请回答下列问题:
(1)装置A中烧瓶内的固体可选用________________。
a. 烧碱 b. 生石灰 c. 二氧化硅 d. 五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:
_________________________________________________________________________。
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格。
B____________;D____________;E____________(填编号)。
(4)在实验过程中应如何合理控制装置A、F中分液漏斗上口的玻璃塞?
_________________________________________________________________________。
(5)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸有___________________________________________________________;所需的玻璃仪器除酒精灯外,还需要__________________________________________ ____。
(6)请写出装置C中生成氯化铵的化学方程式_________________________ _______。
20.(13分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(不需写出反应的方程式) 。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是 ,写出发生反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A、氯水B、H2O2 C、NaOH D、Cu2(OH)2CO3实验小组设计如下实验方案:
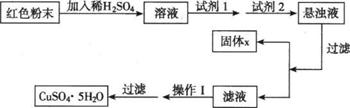
试回答:
①试剂1为 ,试剂2为 (填字母)。
②固体X的化学式为 。
 ③操作Ⅰ
。
③操作Ⅰ
。
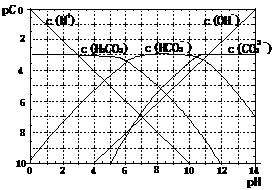
21(11分). pC类似pH,是指极稀溶液中
溶质物质的量浓度的常用对数负值。如某溶液
溶质的浓度为:1×10-3mol/L,则该溶液中该溶
质的pC=-lg1×10-3=3。已知H2CO3溶液中存在
的化学平衡为:


 CO2+H2O H2CO3 H+ +HCO3- 2H++CO32-。
CO2+H2O H2CO3 H+ +HCO3- 2H++CO32-。
右图为H2CO3溶液的pC-pH图。请回答下列问题:
(1)在pH=0-4时,H2CO3溶液中主要存在的离子为: ;在pH=12时,H2CO3溶液中主要存在的含碳阴离子为: ;
(2)pH<5时,溶液中H2CO3的pC值总是约等于3的原因是 ;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是 。
18.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是 ( )
A.该电池Zn为负极,ZnO为正极,MnO2为催化剂
B.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-都能通过薄层纸片
17.25oC时,将1mol/L的醋酸钠溶液用水稀释至0.1mol/L, 溶液中增大的是 ( )
A. c(OH-) B. c(CH3COOH)
C. c(H+) D. c(CH3COOH)/ c(CH3COO-)
16. 下列实验过程中产生的现象与对应的图形正确的是
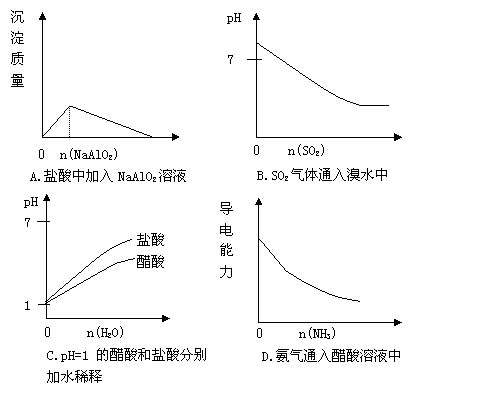
15.下列离子方程式不正确的是 ( )
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.4mol·L-1的NaAlO2溶液和7mol·L-1的HCl等体积互相均匀混合
4AlO2-+ 7H+ + H2O = 3Al(OH)3↓+ Al3+
C.在含有Mn2+的溶液中加入HNO3再加入PbO2,反应体系显紫红色
5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4- + 2H2O
D.溶液中加入足量的银氨溶液并加热
HCHO+2[Ag (NH3)2]++2OH- HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
14.以下是进行氨氧化制硝酸的实验装置图,有关叙述正确的是
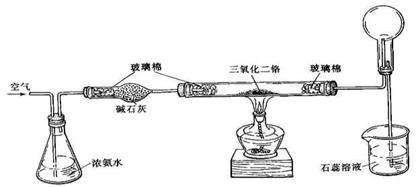
A 烧杯中石蕊溶液变红
B.烧瓶中发生喷泉现象
C.加热后,通过Cr2O3的气体由无色变为红棕色
D.Cr2O3起氧化剂的作用
13.根据相关化学原理分析,下列推断正确的是 ( )
A.若X的质子数为a,中子数为b,则X的质量数为:a-b
B.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性比较为:NaA<NaB
C.若R2-和M+的电子层结构相同,则原子序数的比较为:R>M
D.若有反应A2 + 2D-=== 2A-+D2,则氧化性的比较为:D2>A2
12.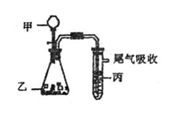 用右图装置进行实验,下表中实验结果能说明结论的是 ( )
用右图装置进行实验,下表中实验结果能说明结论的是 ( )
|
|
甲 |
乙 |
丙 |
结论 |
|
A |
水 |
电石 |
溴水 |
稳定性:水>C2H2>Br2 |
|
B |
盐酸 |
石灰石 |
苯酚钠溶液 |
酸性:HCl>H2CO3>苯酚 |
|
C |
盐酸 |
FeS |
溴水 |
还原性:S2->Br->Cl- |
|
D |
浓盐酸 |
KMnO4 |
KBr溶液 |
氧化性:KMnO4>Cl2>Br2 |
11. 向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是 ( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com