
题目列表(包括答案和解析)
20.(8分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 。
化合反应 。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来制取锰。用铝与软锰矿冶炼锰的原理是(用化学方程式来表示) 。此反应可称做 。
19.(22分)A、B、C、D、E几种常见的化合物或单质之间有如图1转化关系:
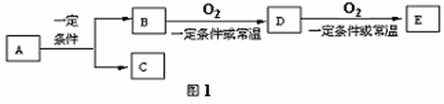
(1)若E是酸酐,D是有刺激性气味的无色气体,则B的化学式是 ,把D通入溴水中,溴水褪色。写出化学方程式 。
(2)若C是酸性气体,B是碱性气体,则E是 , 气体B的检验方法是 。
(3)若A是日常生活中最常见的物质,C为黄绿色单质气体,则D的电子式为
(4)若A是某有机物,其分子空间构型为正四面体,写出下列反应的化学方程式:
 A
B+C
A
B+C
 B
D
B
D
(5)若C是水,B是无氧化合物,且在同系物中是分子相对质量最小的的化合物,E是能使石蕊显红色,则A是 (结构简式式)A、B、D、E中易溶于水的是 (结构简式)。
写出下列反应的化学方程式:
 D
E
D
E
 B
高分子化合物
B
高分子化合物
18.(6分)用铂电极电解KI溶液时,其电极反应为:阴极 ;阳极 ;电解总的化学方程式为 。
17.(5分)电子表和电子计算器常用微型银-锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应分别为:Zn+2OH--2e- =ZnO+H2O Ag2O+H2O+2e- =2Ag+2OH- 总的化学方程式为: 。根据上述变化判断电极材料,正极为 ,负极为 ,工作时 极附近溶液的pH减小。
16.(6分)某同学在实验室测定某溶液的pH,在实验时先用水润湿pH试纸,然后再用洁净的玻璃棒蘸取溶液进行测定。
①该同学的操作 (填“正确”或“错误”)若不正确请说明理由,正确则不答此题
②若按此法测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,
 原因 。
原因 。
15.(3分)下列各物质的溶液物质的量浓度均为0.1mol/L。
①HCl ②NaOH ③Na2CO3 ④CH3COONa⑤NH4Cl ⑥Ba(OH)2 ⑦KCl ⑧CH3COOH 按它们pH由小到大的排列顺序为 (填序号)。
14.某地的酸雨中,含c(Ca2+)=3.6×10-6 mol/L,c(Cl-) = 3.5×10-6 mol/L,c(NH4+)=0.8×10-6 mol/L,c(NO3-) = 4.5×10-6 mol/L,c(SO42-)=5×10-6 mol/L,则该地酸雨的pH为
A.3 B.4 C.5 D.6
第Ⅱ卷(非选择题,共58分)
13. 在15毫升苯中溶解560毫升乙炔,再加入75克苯乙烯,所得混和液中碳元素的质量百分含量为
A. 40% B. 66.7% C. 75% D. 92.3%
12. 将0.2mol丁烷完全燃烧后生成的气体全部缓慢通入0.5L 2mol/L NaOH溶液中,生成的盐的物质的量之比是:
A. Na2CO3︰NaHCO3=3︰2 B. Na2CO3︰NaHCO3=2︰3
C. Na2CO3︰NaHCO3=2︰1 D. Na2CO3︰NaHCO3=1︰3
11.下列除去杂质的方法正确的是
A.除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏
B.除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
C.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com